
题目列表(包括答案和解析)
粗CuO是将工业废铜、废铜合金等高温焙烧而成的,杂质主要是铁的氧化物及泥沙。以粗CuO为原料制备胆矾的主要流程如下:

经操作I得到粗胆矾,操作III得到精制胆矾。两步操作相同,具体包括蒸发浓缩、冷却结晶、过滤、洗涤、干燥等步骤。
已知: 、
、 、
、 转化为相应氢氧化物时,开始沉淀和沉淀完全时的pH如下表:
转化为相应氢氧化物时,开始沉淀和沉淀完全时的pH如下表:
|
|
|
|
|
|
开始沉淀时的pH |
2.7 |
7.6 |
5.2 |
|
完全沉淀时的pH |
3.7 |
9.6 |
6.4 |
(1)溶解、过滤需要用到玻璃棒,它的作用是 。
(2)写出加入3% H2O2后发生反应的离子方程式 。(原溶液显酸性)。
(3)加稀氨水调节pH应调至范围 。下列物质可用来替代稀氨水的是 。(填字母)
A.NaOH B.Cu(OH)2 C.CuO D.NaHCO3
(4)操作III析出胆矾晶体后,溶液中还可能存在的溶质为CuSO4、H2SO4、________________。
(5)某学生用操作III所得胆矾进行“硫酸铜晶体结晶水含量”的测定,数据记录如下表所示:
|
|
第一次实验 |
第二次实验 |
|
坩埚质量(g) |
14.520 |
14.670 |
|
坩埚质量 |
17.020 |
18.350 |
|
第一次加热、冷却、称量(g) |
16.070 |
16.989 |
|
第二次加热、冷却、称量(g) |
16.070 |
16.988 |
两次都无须再做第三次加热、冷却、称量,理由是 ,该生此次实验的相对误差为 %(保留1位小数),产生实验误差的原因可能是
(填字母)。
A.加热前称量时坩埚未完全干燥 B.该胆矾中含有受热不分解的杂质
C.加热后坩埚放在干燥器中冷却 D.玻璃棒上沾有的固体未刮入坩埚
粗CuO是将工业废铜、废铜合金等高温焙烧而成的,杂质主要是铁的氧化物及泥沙。以粗CuO为原料制备胆矾的主要流程如下: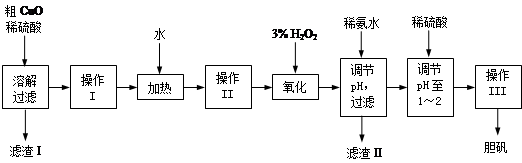
经操作I得到粗胆矾,操作III得到精制胆矾。两步操作相同,具体包括蒸发浓缩、冷却结晶、过滤、洗涤、干燥等步骤。
已知: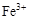 、
、 、
、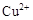 转化为相应氢氧化物时,开始沉淀和沉淀完全时的pH如下表:
转化为相应氢氧化物时,开始沉淀和沉淀完全时的pH如下表:
| | 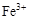 |  | 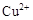 |
| 开始沉淀时的pH | 2.7 | 7.6 | 5.2 |
| 完全沉淀时的pH | 3.7 | 9.6 | 6.4 |
| | 第一次实验 | 第二次实验 |
| 坩埚质量(g) | 14.520 | 14.670 |
坩埚质量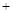 晶体质量(g) 晶体质量(g) | 17.020 | 18.350 |
| 第一次加热、冷却、称量(g) | 16.070 | 16.989 |
| 第二次加热、冷却、称量(g) | 16.070 | 16.988 |
用![]() 和硫粉在水溶液中进行热反应,可以制得
和硫粉在水溶液中进行热反应,可以制得![]() .10℃和70℃时,
.10℃和70℃时,![]() 在100g水中的溶解度分别为60.0g和212g.常温下,从溶液中析出的晶体是
在100g水中的溶解度分别为60.0g和212g.常温下,从溶液中析出的晶体是![]() ,俗称海波.
,俗称海波.![]() 在酸性溶液中立即完全分解:
在酸性溶液中立即完全分解:
![]()
现取15.1g![]() ,溶于80.0mL水.另取5.00g硫粉,用少量乙醇润湿后(以便硫粉被水浸润),加到上述溶液中.用小火加热至微沸,反应约1小时后过滤.滤液在100℃经蒸发、浓缩、冷却至10℃,析出
,溶于80.0mL水.另取5.00g硫粉,用少量乙醇润湿后(以便硫粉被水浸润),加到上述溶液中.用小火加热至微沸,反应约1小时后过滤.滤液在100℃经蒸发、浓缩、冷却至10℃,析出![]() 晶体.
晶体.
(1)若加入的硫粉不用乙醇润湿,对反应的影响是________.(填写选项字母)
[ ]
|
A.会降低反应速率 |
B.需要提高反应温度 |
|
C.将增大反应体系的pH值 |
D.会减少产量 |
(2)反应1小时后过滤.其目的是________.
(3)滤液中除![]() 和可能未反应完全的
和可能未反应完全的![]() 外,最可能存在的无机杂质是________.它是由________而产生的.如果滤液中该杂质的含量不很低,其检测的方法是________.
外,最可能存在的无机杂质是________.它是由________而产生的.如果滤液中该杂质的含量不很低,其检测的方法是________.
(4)设![]() 跟硫粉反应完全,当将滤液蒸发浓缩后,冷却至70℃,溶液的体积约30mL,该溶液是否达到饱和?试通过计算说明.(70℃时
跟硫粉反应完全,当将滤液蒸发浓缩后,冷却至70℃,溶液的体积约30mL,该溶液是否达到饱和?试通过计算说明.(70℃时![]() 饱和溶液的密度为1.17g/cm3)
饱和溶液的密度为1.17g/cm3)
(5)若要计算在100℃下将溶液蒸发至体积为300mL,再冷却至10℃时所能得到的![]() 的质量,你认为________(填写一个选项字母)
的质量,你认为________(填写一个选项字母)
[ ]
A.前面提供的数据已经足够.
B.还需要提供100℃时溶液的密度.
C.还需要提供结晶后剩余溶液的体积.
(16分)用Na2SO3和硫粉在水溶液中加热反应,可以制得Na2S2O3。10℃和70℃时,Na2S2O3在100g水中的溶解度分别为60.0g和212g。常温下,从溶液中析出的晶体是Na2S2O3?5H2O。Na2S2O3在酸性溶液中立即完全分解:
Na2S2O3+2HCl=S↓+SO2↑+H2O+2NaCl
现取15.1gNa2SO3,溶于80.0mL水。另取5.00g硫粉,用少许乙醇润湿后(以便硫能被水浸润),加到上述溶液中。用小火加热至微沸,反应约1h后过滤。滤液在100℃经蒸发、浓缩、冷却至10℃后析出Na2S2O3?5H2O晶体。
⑴若加入的硫粉不用乙醇润湿,对反应的影响是 。(填写选项的字母,可以多选,但选错要倒扣。)
A.会降低反应速率 B.需要提高反应温度
C.将增大反应体系的pH值 D.会减少产量
⑵反应1h后过滤,其目的是 。
⑶滤液中除Na2S2O3和可能未反应完全的Na2SO3外,最可能存在的无机杂质是 。它是由 而产生的。如果滤液中该杂质的含量不很低,其检测的方法是: 。
⑷设Na2SO3跟硫粉完全反应,当将滤液蒸发浓缩后,冷却至70℃,溶液的体积约30mL,该溶液是否达到饱和?试通过计算说明。(70℃时,Na2S2O3饱和溶液的密度为1.17g/cm3)
⑸若要计算在100℃下将溶液蒸发至体积为30.0mL,再冷却至10℃时所能得到的Na2SO3?5H2O的质量,你认为 。(填写一个选项的字母)
A.前面提供的数据已经足够。
B.还需要提供100℃时溶液的密度(1.14g/cm3)。
C.还需要提供结晶后剩余溶液的体积(10.0mL)。
⑹根据第(5)小题你的选择(如选A则直接计算,如选B或C则可选用其数据),计算从10℃、30.0mL溶液中结晶而出的Na2S2O3?5H2O的质量。
用Na2SO3和硫粉在水溶液中加热反应,可以制得Na2S2O3.10℃和70℃时,Na2S2O3在100g水中的溶解度分别为60.0g和212g.常温下,从溶液中析出的晶体是Na2S2O3·5H2O.Na2S2O3在酸性溶液中立即完全分解:Na2S2O3+2HCl![]() S↓+SO2↑+H2O+2NaCl现取15.1g Na2SO3溶于80.0mL水.另取5.00g硫粉,用少许乙醇润湿后(以使硫能被水浸润),加到上述溶液中,用小火加热至微沸,反应约1h后过滤,滤液在100℃经蒸发、浓缩、冷却至10℃后析出Na2S2O3·5H2O晶体.
S↓+SO2↑+H2O+2NaCl现取15.1g Na2SO3溶于80.0mL水.另取5.00g硫粉,用少许乙醇润湿后(以使硫能被水浸润),加到上述溶液中,用小火加热至微沸,反应约1h后过滤,滤液在100℃经蒸发、浓缩、冷却至10℃后析出Na2S2O3·5H2O晶体.
(1)若加入的硫粉不用乙醇润湿,对反应的影响是(填写选项字母,可以多选,但选错要倒扣).
[ ]
A.会降低反应速率
B.需要提高反应温度
C.将增大反应体系的pH值
D.会减少产量
(2)反应1h后过滤,其目的是________.
(3)滤液中除Na2S2O3和可能未反应完全的Na2SO3外,最可能存在的无机杂质是________,它是由________而产生的.如果滤液中该杂质的含量不很低,其检测的方法是________.
(4)设Na2SO3跟硫粉完全反应,当将滤液蒸发浓缩后,冷却至70℃,溶液的体积约30ml,该溶液是否达到饱和?试通过计算说明.(70℃时,Na2S2O3饱和溶液的密度为1.17g/cm3.)
(5)若要计算在100℃下将溶液蒸发至体积为30.0ml,再冷却至10℃时所能得到的Na2S2O3·5H2O的质量,你认为________.(填写一个选项字母)
A.前面提供的数据足够.
B.还需要提供100℃时溶液的密度(1.14g/cm3).
C.还需提供结晶后剩余溶液的体积(10mL).
(6)根据第(5)小题你的选择(如选A则直接计算;如选B或C则可选用其数据),计算从10℃、30.0mL溶液中结晶而出的Na2S2O3的质量.
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com