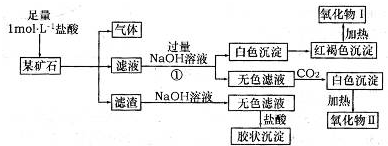
X、Y、Z、L、M五种元素的原子序数依次增大.X、Y、Z、L是组成蛋白质的基础元素,M是生活中最常用的金属,它与L可以形成三种化合物.
请回答下列问题:
(1)Y在元素周期表中的位置为
第二周期,第ⅣA族
第二周期,第ⅣA族
.
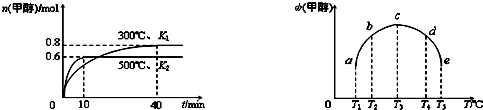
(2)硒(se)是人体必需的微量元素,与L同一主族,该族2~5周期元素单质分别与H
2反应生成l mol气态氢化物的反应热如下,表示生成1mol硒化氢反应热的是
b
b
(填字母代号).
a.+99.7mol?L
-1 b.+29.7mol?L
-1 c.-20.6mol?L
-1 d.-241.8kJ?mol
-1(3)已知(YZ)
2分子所有的原子都满足8电子,请写出其结构式
N≡C-C≡N
N≡C-C≡N
;(YZ)
2可以与X
2化合生成XYZ,其水溶液是一种酸,某浓度该酸的钾盐(KYZ)溶液能使酚酞溶液显红色,请用离子方程式表示原因
CN
-+H
2O

HCN+OH
-CN
-+H
2O

HCN+OH
-.
(4)L、X两元素按原子数目比l:1和1:2形成分子A和B.
①用电子式表示B的形成过程
.
②M在高温下可以与B反应,写出该反应的化学方程式
.
某同学将反应得到的黑色粉末全部溶于足量的硫酸溶液中,发现有少量的气泡产生,溶液呈棕黄色,该同学判断溶液中一定同时存在两种M的金属阳离子.请你选择合适的试剂与合理的步骤证明该同学的推断
取溶液少许,滴加KSCN溶液,溶液变红色,证明有Fe3+,另取溶液少许,加入KMnO4酸性溶液,紫色褪去,证明有Fe2+.
取溶液少许,滴加KSCN溶液,溶液变红色,证明有Fe3+,另取溶液少许,加入KMnO4酸性溶液,紫色褪去,证明有Fe2+.
.
③若该同学将上述棕黄色溶液1mL加入到2mL A的浓溶液中,预计会看到的实验现象是
有大量气泡出现
有大量气泡出现
.

 HCN+OH-
HCN+OH- HCN+OH-
HCN+OH-
