
题目列表(包括答案和解析)
(6分)实验室配制500ml 0.1 mol·L-1的Na2CO3溶液,回答下列问题:
(1)应用托盘天平称取碳酸钠粉末 g。
(2)配制时应选用的仪器有500ml容量瓶,托盘天平、烧杯、药匙、 。
(3)若实验时遇到下列情况,所配溶液的浓度偏大的是 。
A、加水定容时超过刻度线,又吸出少量水至刻度线; B、忘记将洗涤液转入容量瓶;
C、容量瓶洗涤后内壁有水珠而未作干燥处理;
D、称量碳酸钠粉末时左盘放砝码,右盘放药品;
E、定容时俯视刻度线。
(6分)实验室配制500ml 0.1 mol·L-1的Na2CO3溶液,回答下列问题:
(1)应用托盘天平称取碳酸钠粉末 g。
(2)配制时应选用的仪器有500ml容量瓶,托盘天平、烧杯、药匙、 。
(3)若实验时遇到下列情况,所配溶液的浓度偏大的是 。
A、加水定容时超过刻度线,又吸出少量水至刻度线; B、忘记将洗涤液转入容量瓶;
C、容量瓶洗涤后内壁有水珠而未作干燥处理;
D、称量碳酸钠粉末时左盘放砝码,右盘放药品;
E、定容时俯视刻度线。
实验室配制500ml 0.1 mol·L-1的Na2CO3溶液,回答下列问题:
(1)应用托盘天平称取碳酸钠粉末 g。
(2)配制时应选用的仪器有500ml容量瓶,托盘天平、烧杯、药匙、 。
(3)若实验时遇到下列情况,所配溶液的浓度偏大的是 。
A、加水定容时超过刻度线,又吸出少量水至刻度线; B、忘记将洗涤液转入容量瓶;
C、容量瓶洗涤后内壁有水珠而未作干燥处理;
D、称量碳酸钠粉末时左盘放砝码,右盘放药品;
E、定容时俯视刻度线。
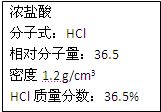 右图为实验室某浓盐酸试剂瓶上的标签,试根据有关数据回答下列问题:
右图为实验室某浓盐酸试剂瓶上的标签,试根据有关数据回答下列问题:湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com