
题目列表(包括答案和解析)
(09烟台26).(9分)海水是一种重要的自然资源。以下是我市对海水资源的部分利用。
(1)从海水中获取淡水。常用的操作方法是 。
(2)从海水中获得氯化钠。将海水进行 可得到粗盐;为除去粗盐中含有
的SO42-、Ca2+、Mg2+等杂质,-有如下操作:①溶解;②加过量的Na2CO3溶液; ③加过量的BaCl2溶液;④加适量的盐酸;⑤加过量NaOH溶液;⑥蒸发结晶;⑦过滤。正确的操作顺序是 。(用序号填一种合理组合)。
(3)从海水中得到金属镁。下图是从海水中提取镁的简单流程。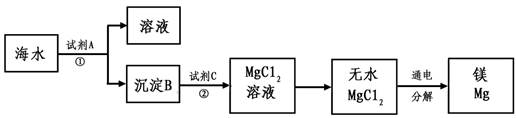
上述过程中,沉淀B与试剂C发生的是中和反应,则沉淀B的化学式为 ,由无水MgCl2制取Mg的化学方程式为 。海水本身就是含有MgCl2的溶液,它与通过步骤①、②得到的MgCl2溶液有何不同:
。
(4)海水“制碱”。下图是海水“制碱”的部分简单流程。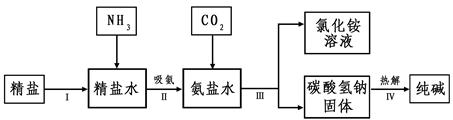
步骤Ⅲ、步骤Ⅳ反应的化学方程式为: 、
。
制氨盐水的过程中要先通入氨气,再通入二氧化碳。如果反过来,二氧化碳的吸收率会降低。这是因为 。
(09烟台26).(9分)海水是一种重要的自然资源。以下是我市对海水资源的部分利用。
(1)从海水中获取淡水。常用的操作方法是 。
(2)从海水中获得氯化钠。将海水进行 可得到粗盐;为除去粗盐中含有
的SO42-、Ca2+、Mg2+等杂质,-有如下操作:①溶解;②加过量的Na2CO3溶液; ③加过量的BaCl2溶液;④加适量的盐酸;⑤加过量NaOH溶液;⑥蒸发结晶;⑦过滤。正确的操作顺序是 。(用序号填一种合理组合)。
(3)从海水中得到金属镁。下图是从海水中提取镁的简单流程。
上述过程中,沉淀B与试剂C发生的是中和反应,则沉淀B的化学式为 ,由无水MgCl2制取Mg的化学方程式为 。海水本身就是含有MgCl2的溶液,它与通过步骤①、②得到的MgCl2溶液有何不同:
。
(4)海水“制碱”。下图是海水“制碱”的部分简单流程。
步骤Ⅲ、步骤Ⅳ反应的化学方程式为: 、
。
制氨盐水的过程中要先通入氨气,再通入二氧化碳。如果反过来,二氧化碳的吸收率会降低。这是因为 。
(2012年山东烟台,28题,8分)(8分)2012年3月6日,包括圆明园兽首在内的一批珍贵文物首次在烟台展出。小霞看到这些240年前的铜质兽首后,她想探究铜是怎么冶炼出来的。
【查阅资料】(1)冶炼铜可以用常见的铜矿石——孔雀石,其主要成分是碱式碳酸铜[Cu2(OH)2CO3]。碱式碳酸铜是一种绿色的不溶于水的固体,加热易分解,能与酸反应。Cu2(OH)2CO3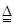 2CuO+CO2↑+H20, Cu2(OH)2CO3+4HCl===2CuCl2+CO2↑+3H2O。
2CuO+CO2↑+H20, Cu2(OH)2CO3+4HCl===2CuCl2+CO2↑+3H2O。
(2)实验室可以用至少三种方法来制取铜:①用氢气在加热的条件下还原氧化铜(生成铜和水);②电解氯化铜溶液(生成铜和氯气,氯气有毒);③用活泼金属从铜的盐溶液中置换。
【设计方案】在实验室中以碱式碳酸铜、铁粉、稀盐酸为原料来制取铜。请你仿照下图①帮她画出另外两种制取铜的流程图。
①
②
③
【反思评价】(1)上述三种制取铜的方案中,你认为最理想的是_________,与其他两种方案比较,它有哪些优点(至少答一点):_______________________
__________________________________________。
(2)铜锈的主要成分也是碱式碳酸铜[Cu2(OH)2CO3]。铜生锈除了与空气中的氧气和水关外,从碱式碳酸铜的化学式推知,还可能与空气中的____________有关。
(09茂名市)(8分)铬(Cr)为不锈钢主要的添加元素,含量一般在12%以上。铬的表面生成一薄层致密的钝态氧化物保护膜是不锈钢具有耐蚀性主要原因。请回答下列问题:
(1)铁生锈的主要条件是铁与________和________直接接触。
(2)不锈钢是一种____________(填“合金”或“金属”)。
(3)相同温度下,取大小相同、表面光亮的Cr、Mg、Cu三种金属薄片,分别投入等体积等溶质质量分数的足量稀盐酸中(反应中Cr显+2价),现象如下:
| 金属 | Cr | Mg | Cu |
| 与盐酸反应现象 | 放出气泡速率缓慢 | 放出气泡速率较快 | 无明显现象 |
(09南平市)(8分)请根据常见金属性质回答问题:
(1)将以下常见金属的活动顺序补充完整。

金属活动性由强逐渐减弱
(2)黄金首饰不易锈蚀的主要原因是 。
(3)从Mg、Zn、Cu、Fe中选出适当的物质与稀硫酸反应,写出反应的化学方程式
(写一个即可)。
(4)用CuSO4 配制农药波尔多液时不能在以下 (填序号)中进行。
A.塑料桶 B.铁桶 C.木桶
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com