
题目列表(包括答案和解析)
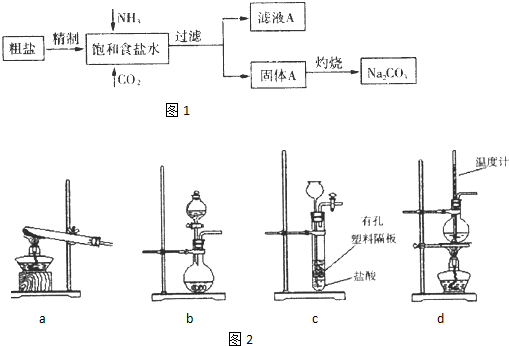
| ||
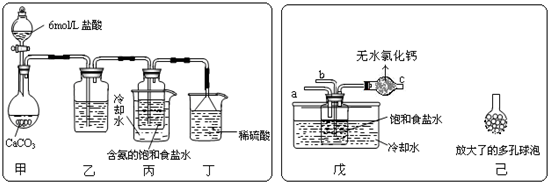
作为高中生,学会利用我们课堂上学到的知识来解决生活中的一些问题,是我们学习的重要目的之一。重庆一中某化学实验兴趣小组,一行四人,利用实验室老师提供的基本仪器和药品,自行购置了鸡蛋,食醋等生活用品,进行了如下探究。
I. 甲同学老家在山西,对儿时在家乡品尝到的山西老陈醋的滋味记忆犹新,跟随父母来到重庆后,总是觉得超市买到的醋不如儿时的味道,查阅相关资料后,得知以下信息:
①醋分两种,酿造醋和配制醋。正宗的老陈醋必须经长久时间酿造才得此美味,市场上多充斥着工业醋酸加水勾兑的配制醋。
②酿造醋国家标准为醋酸含量必须大于3.50 g/100mL,而配制醋国家标准仅为1.50 g~3.50g/100mL。
③在老师的帮助下,测定了超市购买的食醋中,醋酸的物质的量浓度为0.75mol/L。
(1)请帮助张同学计算从超市购买的食醋中醋酸含量为_______g/100mL,属于____________醋(填“酿造”或“配制”)。(提示:醋酸摩尔质量为60g/mol)
(2)请写出醋酸与鸡蛋壳(主要成分为CaCO3)反应的离子方程式_______________________________。
II. 下图是重庆一中化学实验室浓盐酸试剂标签上的部分内容。乙同学现用该浓盐酸配100mL1mol/L的稀盐酸。可供选用的仪器有:①胶头滴管;②烧瓶;③烧杯;④药匙;⑤量筒;⑥托盘天平;⑦玻璃棒。请回答下列问题:
(1)配制稀盐酸时,还缺少的仪器有 ;
(2)经计算,配制100mL1mol/L的稀盐酸需要用量筒量取上述浓盐酸的体积为 mL(保留小数点后一位);
(3)对所配制的稀盐酸进行测定,发现其浓度小于1mol/L,引起误差的原因可能是 。
| A.定容时俯视容量瓶刻度线 |
| B.容量瓶在使用前未干燥,里面有少量蒸馏水 |
| C.转移溶液后,未洗涤烧杯和玻璃棒 |
| D.定容摇匀后发现液面低于容量瓶的刻度线,再加水至刻度线 |
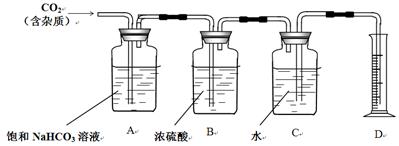
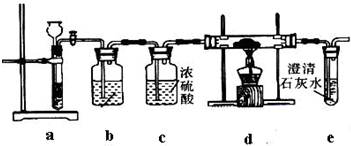
| ||
| ||
第一步:连接好装置,检验气密性,在各仪器内装入药品。
第二步:先让一装置发生反应,直到产生的气体不能再在C中溶解时,再通入另一装置中产生的气体,片刻后C中出现固体。继续向C中通入两种气体,直到不再有固体产生。
第三步:过滤C中所得的混合物,并用蒸馏水洗涤晶体,得到NaHCO3固体。
第四步:向滤液中通氨气,加入细小食盐颗粒,冷却析出副产品NH4Cl晶体。
请回答下列问题:

(1)装置的接口连接时a接_____________。
D中所盛试剂的名称是_____________。
(2)第二步中必须先让_____________(填编号)装置发生反应。
(3)C中用球形干燥管而不用直导管,其作用是___________________________,C中广口瓶内产生固体的总化学方程式为______________________________。
(4)第三步中用蒸馏水洗涤晶体的目的是除去______________________________杂质(以化学式表示)。
(5)向滤液中通氨气的目的是_____________。(填序号)
a.增大![]() 的浓度,使NH4Cl更多地析出
的浓度,使NH4Cl更多地析出
b.使NaHCO3更多地析出
(6)测试纯碱产品中NaHCO3含量的方法是:准确称取纯碱样品W g,放入锥形瓶中加蒸馏水溶解,加1—2滴酚酞指示剂,用物质的量浓度为c mol·L-1的HCl溶液滴定至溶液由红色到无色(指示![]() +H+====
+H+====![]() 反应的终点),所用HCl溶液体积为V1 mL,再加1—2滴甲基橙指示剂,继续用上述HCl溶液滴定至溶液由黄变橙,又用去HCl溶液的体积为V2 mL。写出纯碱样品中NaHCO3质量分数的计算式:
反应的终点),所用HCl溶液体积为V1 mL,再加1—2滴甲基橙指示剂,继续用上述HCl溶液滴定至溶液由黄变橙,又用去HCl溶液的体积为V2 mL。写出纯碱样品中NaHCO3质量分数的计算式:
w(NaHCO3)=________________________________________________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com