
题目列表(包括答案和解析)
某课外活动小组加热炭粉(过量)和氧化铜的混合物,再用下图装置,对获得的铜粉(含炭)样品进行实验。图中铁架台等装置已略去。请你帮助他们完成下列实验报告。
(1)实验目的:测定铜粉样品中铜的质量分数
(2)实验用品:仪器:天平、分液漏斗、锥形瓶、硬质玻璃管、干燥管、酒精灯、洗气瓶等,药品:红褐色铜粉(含炭)样品、过氧化氢溶液、二氧化锰、碱石灰、浓硫酸等。
(3)实验内容(见表1)表1 实验步骤、现象及化学方程式:
(4)计算:样品中铜的质量分数=______。(用含W、m1、m2的代数式表示。)
(5)问题和讨论:实验完成后,老师评议说:按上述实验设计,即使C中反应完全、D中吸收完全,也不会得出正确的结果。经讨论,有学生提出在B与C之间加入一个装置,再次实验后,得到了较正确的结果。那么,原来实验所测得的铜的质量分数偏小的原因可能是__________。在B与C之间加入的 装置可以是_____________,其中盛放的药品是____________。
装置可以是_____________,其中盛放的药品是____________。
某课外活动小组加热炭粉(过量)和氧化铜的混合物,再用下图装置,对获得的铜粉(含炭)样品进行实验。图中铁架台等装置已略去。请你帮助他们完成下列实验报告。

(1)实验目的:测定铜粉样品中铜的质量分数
(2)实验用品:仪器:天平、分液漏斗、锥形瓶、硬质玻璃管、干燥管、酒精灯、洗气瓶等,药品:红褐色铜粉(含炭)样品、过氧化氢溶液、二氧化锰、碱石灰、浓硫酸等。
(3)实验内容(见表1)表1 实验步骤、现象及化学方程式:
(4)计算:样品中铜的质量分数=______。(用含W、m1、m2的代数式表示。)
(5)问题和讨论:实验完成后,老师评议说:按上述实验设计,即使C中反应完全、D中吸收完全,也不会得出正确的结果。经讨论,有学生提出在B与C之间加入一个装置,再次实验后,得到了较正确的结果。那么,原来实验所测得的铜的质量分数偏小的原因可能是__________。在B与C之间加入的装置可以是_____________,其中盛放的药品是____________。
①将5%Na2CO3溶液加入到盛有一定量废铁屑的烧杯中,加热数分钟,用倾析法除去Na2CO3溶液,然后将废铁屑用水洗涤2—3遍。
②向洗涤过的废铁屑加入过量的稀硫酸,控制温度50—80 ℃之间至铁屑耗尽。
③趁热过滤,将滤液转入到密闭容器中,静置、冷却结晶。
④待结晶完毕后,滤出晶体,用少量冰水洗涤2—3次,再用滤纸将晶体吸干。
⑤将制得的FeSO4·7H2O晶体放在一个小广口瓶中,密闭保存。
请完成下列问题:
(1)实验步骤①的目的是____________,加热的作用是______________________________。
(2)实验步骤②明显不合理,理由是______________________________________________。
(3)实验步骤④中用少量冰水洗涤晶体,其目的是__________________________________。
(4)经查阅资料后发现,硫酸亚铁在不同温度下结晶可分别得到FeSO4·7H2O、FeSO4·4H2O和FeSO4·H2O。硫酸亚铁在不同温度下的溶解度和该温度下析出晶体的组成如下表所示(仅在56.7 ℃、64 ℃温度下可同时析出两种晶体)。
温度/℃ | 0 | 10 | 30 | 50 | 56.7 | 60 | 64 | 70 | 80 | 90 | ||
溶解度/g | 14.0 | 17.0 | 25.0 | 33.0 | 35.2 | 35.3 | 35.6 | 33.0 | 30.5 | 27.0 | ||
析出晶体 | FeSO4·7H2O | FeSO4·4H2O | FeSO4·H2O | |||||||||
请根据表中数据作出硫酸亚铁的溶解度曲线。
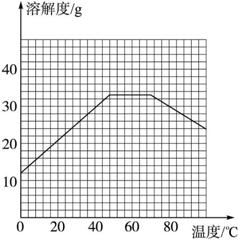
图3-8
(5)若从硫酸亚铁溶液中结晶出FeSO4·4H2O晶体,应控制的结晶温度(t)的范围为_______。
如图是一套实验室制取乙烯并验证乙烯具有还原性的实验装置。
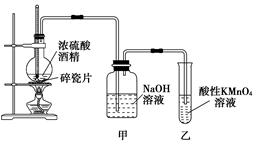
请回答:
(1)实验步骤:①____________________________________________________________;
②在各装置中注入相应的试剂(如图所示);
③________________________________________________________________________;
实验时,烧瓶中液体混合物逐渐变黑。
(2)能够说明乙烯具有还原性的现象是
________________________________________________________________________
________________________________________________________________________;
装置甲的作用是_____________________________________________________________。
若无此装置,是否也能检验乙烯具有还原性,简述其理由:
________________________________________________________________________
________________________________________________________________________。
某课外活动小组加热炭粉(过量)和氧化铜的混合物,再用下图装置,对获得的铜粉(含炭)样品进行实验。图中铁架台等装置已略去。请你帮助他们完成下列实验报告。

(1)实验目的:测定铜粉样品中铜的质量分数
(2)实验用品:仪器:天平、分液漏斗、锥形瓶、硬质玻璃管、干燥管、酒精灯、洗气瓶等,药品:红褐色铜粉(含炭)样品、过氧化氢溶液、二氧化锰、碱石灰、浓硫酸等。
(3)实验内容(见表1)表1 实验步骤、现象及化学方程式:
(4)计算:样品中铜的质量分数=______。(用含W、m1、m2的代数式表示。)
(5)问题和讨论:实验完成后,老师评议说:按上述实验设计,即使C中反应完全、D中吸收完全,也不会得出正确的结果。经讨论,有学生提出在B与C之间加入一个装置,再次实验后,得到了较正确的结果。那么,原来实验所测得的铜的质量分数偏小的原因可能是__________。在B与C之间加入的装置可以是_____________,其中盛放的药品是____________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com