
题目列表(包括答案和解析)
物质在水溶液中有不同的行为。按要求回答下列问题:
(1)Na2SO3溶液显碱性,其原因是______________________________(用离子方程式表示),该溶液中各离子浓度由大到小的顺序为______________________。
(2)室温下向10mL氨水溶液中加水稀释后,下列量增大的有__________(填编号,下同),减小的有___________,不变的有____________。
a.溶液中离子浓度? ??????? b.氨水的电离程度
c.水的离子积常数????????? d.c(H+)/ c(NH3·H2O)
(3)亚氯酸钠(NaClO2)是一种强氧化性漂白剂,广泛用于纺织、印染和食品工业。NaClO2变质可分解为NaClO3和NaCl。取等质量已变质和未变质的NaClO2试样均配成溶液,分别与足量FeSO4溶液反应时,消耗Fe2+的物质的量??????????????? (填“相同”或“不相同”),其原因是??????????????????????????????????? 。
物质在水溶液中有不同的行为。按要求回答下列问题:
(1)Na2SO3溶液显碱性,其原因是______________________________(用离子方程式表示),该溶液中各离子浓度由大到小的顺序为______________________。
(2)室温下向10mL氨水溶液中加水稀释后,下列量增大的有__________(填编号,下同),减小的有___________,不变的有____________。
a.溶液中离子浓度 b.氨水的电离程度
c.水的离子积常数 d.c(H+)/ c(NH3·H2O)
(3)亚氯酸钠(NaClO2)是一种强氧化性漂白剂,广泛用于纺织、印染和食品工业。NaClO2变质可分解为NaClO3和NaCl。取等质量已变质和未变质的NaClO2试样均配成溶液,分别与足量FeSO4溶液反应时,消耗Fe2+的物质的量 (填“相同”或“不相同”),其原因是 。
(1)现用物质的量浓度为amol/L的标准盐酸去测定VmLNaOH溶液的物质的量浓度,请填写下列空白:
①酸式滴定管用蒸馏水洗净后,还应该进行的操作是_______________________。
②下图是酸式滴定管中液面在滴定前后的读数,则被测NaOH溶液的的物质的量浓度为:c(NaOH)= ________________。
③若在滴定前滴定管尖嘴部分留有气泡,滴定后滴定管尖嘴部分气泡消失,则测得的NaOH溶液的物质的量浓度会偏_________________。
(2)平衡常数表明了封闭体系的可逆反应在给定的温度下进行的程度,对于同一个类型的反应,平衡常数越大,表明反应进行的程度越大。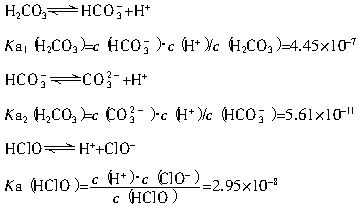
请依据以上碳酸和次氯酸的电离平衡常数,写出在下列条件下所发生反应的离子方程式:
①将过量的氯气通入到少量的碳酸钠溶液中______________________________________;
②氯气和碳酸钠按照1∶1的比例恰好反应_____________________________________。
(3)铬是1979年法国化学家沃克兰在分析铬铅矿时首先发现的。铬位于周期表中第四周期ⅥB族,其主要化合价为+6、+3、+2,其中+3较为稳定。某兴趣小组对铬的化合物进行探究性研究发现:Cr2O3微溶于水,与A12O3类似,是两性氧化物;Cr(OH)3和Al(OH)3类似,也是两性氢氧化物,在水中存在酸式和碱式电离平衡。Cr(OH)3酸式电离的电离方程式是:_________。
题号
1
2
3
4
5
6
7
8
答案
C
C
A
B
C
D
B
A
题号
9
10
11
12
13
14
15
16
答案
B
B
C
D
B
A
C
D

|