常温下,将FeCl
3溶液和KI溶液混合,发生如下反应:
2Fe
3++2I
-?2Fe
2++I
2某研究小组为了证明FeCl
3溶液和KI溶液的反应存在一定限度,设计了如下实验:取5mL 0.1mol?L
-1 KI溶液,滴加0.1mol?L
-1 FeCl
3溶液5~6滴,充分反应后溶液呈黄褐色,加入2mL CCl
4溶液,振荡后静置,取上层溶液,滴加KSCN试剂,观察实验现象.
已知:v(正)=k?c
m(I
-)?c
n(Fe
3+)(k为常数)
根据以上信息回答下列问题:
(1)能够证明反应存在限度的现象是
.加入四氯化碳的作用是
.
(2)甲同学按上述步骤进行实验,结果并未观察到预期现象,推测可能原因是反应后溶液中Fe
3+浓度过低.为此,甲又做了下列对比实验,实验结果记录如下:
| 氯化铁溶液用量 |
10滴 |
20滴 |
30滴 |
2mL |
3mL |
4mL |
| 萃取后上层溶液颜色 |
黄色 |
黄色 |
黄色 |
较深黄色 |
黄色略带红色 |
黄红色 |
| 加入KSCN溶液后颜色 |
不变红 |
不变红 |
略变红 |
偏血红色 |
血红色 |
血红色 |
分析实验记录,甲认为导致Fe
3+浓度过低的原因是
;乙同学结合平衡移动的知识,认为还有一个原因是
.
(3)该反应的平衡常数表达式为
.
(4)已知改变I
-、Fe
3+的浓度,正反应速率对应数值如下表所示:
|
c(I-)/mol?L-1 |
c(Fe3+)/mol?L-1 |
v/mol?L-1?s-1 |
| ① |
0.20 |
0.80 |
0.032k |
| ② |
0.60 |
0.40 |
0.144k |
| ③ |
0.80 |
0.20 |
0.128k |
分析表中数据,I
-浓度对反应速率的影响
Fe
3+浓度对反应速率的影响(填“大于”、“小于”或“等于”),理由是(写出计算过程)
.
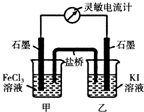
(5)现将反应2Fe
3++2I
-?2Fe
2++I
2设计成如图所示的原电池
①能说明反应达到平衡的标志是
(填序号).
a.电流计读数为零 b.电流计指针不再偏转且不为零
c.电流计指针偏转角度最大 d.甲烧杯中溶液颜色不再改变
②反应达平衡后,向甲中加入适量FeCl
2固体,此时
(填“甲“或“乙”)中石墨电极为负极,对应的电极反应方程式为
.

 2Z(g)+a Q(g);△H=b kJ/mol.达到平衡时生成0.8mol Z,测得Q的浓度为0.4mol/L,下列叙述正确的是( )
2Z(g)+a Q(g);△H=b kJ/mol.达到平衡时生成0.8mol Z,测得Q的浓度为0.4mol/L,下列叙述正确的是( )