
题目列表(包括答案和解析)
工业制硫酸时,利用催化氧化反应将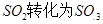 是一个关键的步骤。
是一个关键的步骤。
(1)某温度下,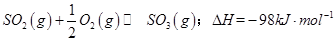 。开始时在100L的密闭容器中加入4.0molSO2(g)和10.0molO2,当反应达到平衡时共放出热量196kJ,该温度下平衡常数K=____________。
。开始时在100L的密闭容器中加入4.0molSO2(g)和10.0molO2,当反应达到平衡时共放出热量196kJ,该温度下平衡常数K=____________。
(2)一定条件下,向一带活塞的密闭容器中充入2mol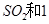 mol
mol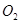 ,发生反应:
,发生反应: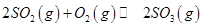 ,达平衡后改变下述条件,
,达平衡后改变下述条件,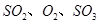 气体平衡浓度都比原来增大的是____________(填字母)。
气体平衡浓度都比原来增大的是____________(填字母)。
A.保持温度和容器体积不变,充入2mol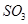
B.保持温度和容器体积不变,充入2molN2
C.保持温度和容器内压强不变,充入1mol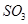
D.移动活塞压缩气体
E.升高温度
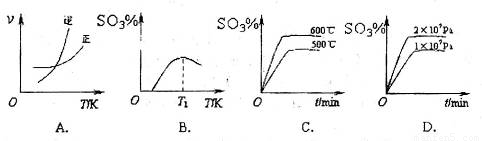
(3)下列关于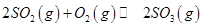 反应的图像中,不正确的是_________。
反应的图像中,不正确的是_________。
(4)同学们学习了电化学知识后大家提出,可以用电解的方法来生产硫酸,可避免产生酸雨,污染环境。于是大家设计了一个以铂为电极,两极分别通入SO2和空气,酸性电解液来实现电解生产硫酸。
①阳极的电极反应为______________________________。
②若电解液为2L0.025mol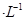 的硫酸溶液,当电解过程共转移了0.1mol电子时,理论上消耗SO2的体积为(标准状况)为_________,此溶液的pH=__________
(忽略溶液体积变化)。
的硫酸溶液,当电解过程共转移了0.1mol电子时,理论上消耗SO2的体积为(标准状况)为_________,此溶液的pH=__________
(忽略溶液体积变化)。
③设计此实验的想法得到了老师的充分肯定,但与工业上生产硫酸相比还是有很多不足,请对此实验进行合理的评价____________________________(写出一点即可)。
工业制硫酸时,利用催化氧化反应将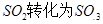 是一个关键的步骤。
是一个关键的步骤。
(1)某温度下,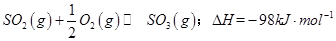 。开始时在100L的密闭容器中加入4.0molSO2(g)和10.0molO2,当反应达到平衡时共放出热量196kJ,该温度下平衡常数K=____________。
。开始时在100L的密闭容器中加入4.0molSO2(g)和10.0molO2,当反应达到平衡时共放出热量196kJ,该温度下平衡常数K=____________。
(2)一定条件下,向一带活塞的密闭容器中充入2mol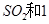 mol
mol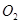 ,发生反应:
,发生反应: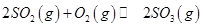 ,达平衡后改变下述条件,
,达平衡后改变下述条件, 气体平衡浓度都比原来增大的是____________(填字母)。
气体平衡浓度都比原来增大的是____________(填字母)。
A.保持温度和容器体积不变,充入2mol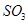 |
| B.保持温度和容器体积不变,充入2molN2 |
C.保持温度和容器内压强不变,充入1mol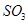 |
| D.移动活塞压缩气体 |
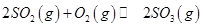 反应的图像中,不正确的是_________。
反应的图像中,不正确的是_________。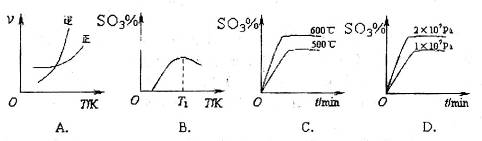
 的硫酸溶液,当电解过程共转移了0.1mol电子时,理论上消耗SO2的体积为(标准状况)为_________,此溶液的pH="__________" (忽略溶液体积变化)。
的硫酸溶液,当电解过程共转移了0.1mol电子时,理论上消耗SO2的体积为(标准状况)为_________,此溶液的pH="__________" (忽略溶液体积变化)。  O2(g)?SO3(g);△H=-98kJ?mol-1.开始时在100L的密闭容器中加入4.0mol SO2(g)和10.0molO2(g),当反应达到平衡时共放出热量196kJ,该温度下平衡常数K=______.
O2(g)?SO3(g);△H=-98kJ?mol-1.开始时在100L的密闭容器中加入4.0mol SO2(g)和10.0molO2(g),当反应达到平衡时共放出热量196kJ,该温度下平衡常数K=______.
 是一个关键的步骤。
是一个关键的步骤。 。开始时在100L的密闭容器中加入4.0molSO2(g)和10.0molO2,当反应达到平衡时共放出热量196kJ,该温度下平衡常数K=____________。
。开始时在100L的密闭容器中加入4.0molSO2(g)和10.0molO2,当反应达到平衡时共放出热量196kJ,该温度下平衡常数K=____________。 mol
mol ,发生反应:
,发生反应: ,达平衡后改变下述条件,
,达平衡后改变下述条件, 气体平衡浓度都比原来增大的是____________(填字母)。
气体平衡浓度都比原来增大的是____________(填字母)。A.保持温度和容器体积不变,充入2mol |
| B.保持温度和容器体积不变,充入2molN2 |
C.保持温度和容器内压强不变,充入1mol |
| D.移动活塞压缩气体 |
 反应的图像中,不正确的是_________。
反应的图像中,不正确的是_________。
 的硫酸溶液,当电解过程共转移了0.1mol电子时,理论上消耗SO2的体积为(标准状况)为_________,此溶液的pH="__________" (忽略溶液体积变化)。
的硫酸溶液,当电解过程共转移了0.1mol电子时,理论上消耗SO2的体积为(标准状况)为_________,此溶液的pH="__________" (忽略溶液体积变化)。 短周期元素X,其原子最外层中未成对电子数最多,该元素的氢化物是常见的10电子极性分子,下列说法不正确的是
A.该元素位于周期表的第VA族
B.同主族元素形成的氢化物中,其熔、沸点最低
C.该元素的氢化物与其最高价氧化物的水化物形成的化合物中既含有离子键还含有极性键和配位键
D.该元素的单质中含有一个σ键和两个π键
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com