氯碱工业是高耗能产业,为了提高原料的利用率,将电解的Y气体作为燃料电池的燃料,为电解池供电;X气体作为钛的冶炼原料,在这种工艺设计中,相关物料的传输与转化关系如图所示,其中氯碱工业装置中的电极未标出,所用的离子膜都只允许阳离子通过.如图所示:
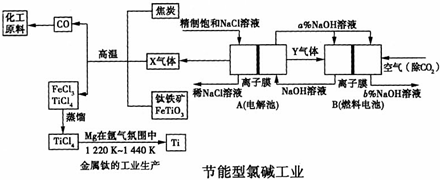
(1)①图中的节能型氯碱工业部分,X、Y分别是
Cl2
Cl2
、
H2
H2
(填化学式),分析比较图示中氢氧化钠质量分数8%与6%的大小为
a%<b%
a%<b%
;
②分别写出燃料电池B中正、负极上发生的电极反应,正极:
O2+4e-+2H2O═4OH-
O2+4e-+2H2O═4OH-
,负极:
H2-2e-+2OH-═2H2O
H2-2e-+2OH-═2H2O
;
③这样设计的主要节(电)能之处在于(写出两点):
燃料电池可以为电解池补充电能
燃料电池可以为电解池补充电能
、
提高产品氢氧化钠的浓度,降低能耗
提高产品氢氧化钠的浓度,降低能耗
.
(2)写出钛铁矿经氯化法得到四氯化钛的化学方程式:
2FeTiO
3+6C+7Cl
22FeCl
3+2TiCl
4+6CO
2FeTiO
3+6C+7Cl
22FeCl
3+2TiCl
4+6CO
.
(3)TiCl
4暴露在潮湿空气中冒白烟,白烟主要为白色的二氧化钛的水合物H
2TiO
3,写出该反应的化学方程式:
TiCl4+3H2O═H2TiO3+4HCl
TiCl4+3H2O═H2TiO3+4HCl
.
(4)已知:①
Mg(s)+Cl2(g)MgCl2(s)△H=-641kJ?mol
-1②
Ti(s)+Cl2(g)TiCl4(I)△H=-385kJ?mol
-1写出Mg与TiCl
4反应的热化学方程式:
2Mg(s)+TiCl4(s)═2MgCl2(s)+Ti(s)△H-512kJ?mol-1
2Mg(s)+TiCl4(s)═2MgCl2(s)+Ti(s)△H-512kJ?mol-1
,反应在氩气氛围中进行的原因是
Mg和Ti都有强还原性,在Ar气氛中可以防止被氧化
Mg和Ti都有强还原性,在Ar气氛中可以防止被氧化
.

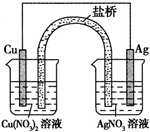 (1)实验证明能设计成原电池的反应通常是放热反应,下列化学反应在理论上可以设计成原电池的是
(1)实验证明能设计成原电池的反应通常是放热反应,下列化学反应在理论上可以设计成原电池的是