
题目列表(包括答案和解析)
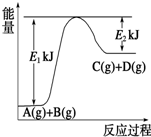 Ⅰ.已知某反应A(g)+B(g)?C(g)+D(g),过程中的能量变化如图所示,回答下列问题.
Ⅰ.已知某反应A(g)+B(g)?C(g)+D(g),过程中的能量变化如图所示,回答下列问题.
.甲醛是一种重要的化工产品,可以利用甲醇脱氢制备,反应式如下:
①CH30H(g)=CH20(g)+H2(g) △H1=+84.2kJ·mol-1
向反应体系中通入氧气,通过反应②2H2(g)+O2(g)=2H2O(g) △H2=-483.6 kJ·mol-1 提供反应①所需热量,要使反应温度维持在700°c,则进料中甲醇与氧气的物质的量之比为
A.5.74:1 B.11.48:1 C.1:l D.2:l
(14分)Ⅰ.在用稀硫酸与锌制取氢气的实验中,加入少量硫酸铜溶液可加快氢气的生成速率。请回答下列问题:
(1)加入少量硫酸铜溶液可以加快氢气生成速率的原因是 ;
(2)要加快上述实验中气体产生的速率,还可采取的措施有 (答两种);
(3)为了进一步研究硫酸铜的量对氢气生成速率的影响,某学习小组设计了如下一系列实验。将表中所给的混合溶液分别加入到6个盛有过量Zn粒的反应瓶中,收集产生的气体,记录获得相同体积的气体所需时间。
| 实 验 混合溶液 | A | B | C | D | E | F |
| 4 mol·L-1H2SO4 / mL | 30 | V1 | V2 | V3 | V4 | V5 |
| 饱和CuSO4溶液 / mL | 0 | 0.5 | 2.5 | 5 | V6 | 20 |
| H2O / mL | V7 | V8 | V9 | 15 | 10 | 0 |
请完成此实验设计,其中:V2 V5= , V6= ,V8= ;
(第一空填“>”、“<”或“=”;后三空填具体数值)
Ⅱ.常温下,某一元酸HA和NaOH溶液等体积混合,HA和NaOH的浓度以及混合后溶液的pH如下表:
| 组别 | c(HA)/mo1·L-1 | c(NaOH)/mo1·L-1 | 混合液pH |
| 甲 | c | 0.2 | pH = 7 |
| 乙 | 0.2 | 0.1 | pH>7 |
| 丙 | 0.1 | 0.1 | pH = 9 |
请回答下列问题:
(4)仅从甲组情况分析,c是否一定等于0.2 ? (选填“是”或“否”)。
(5)分析乙组实验数据,HA是 酸(选填“强”或“弱”)。该混合液中离子浓度由大到小的顺序是 。
(6)丙组所得混合液中由水电离出的c(OH-) = mo1·L-1。
1D。2D。3B。4BD。5BC。6BD。
13D(从离子的核外电子数之和为20可推出M、R两种原子的核外电子数之和为19,所以符合题示条件的M、R可能有多种答案。但M、R的质子数之差不可能是7)。
ⅠA
ⅡA
ⅢA
ⅣA
ⅤA
ⅥA
ⅦA
0
D
C
A
B
进而很容易判断出,原子序数的大小是B>A>C>D)。
16D。 w.w.w.k.s.5.u.c.o.m
w.w.w.k.s.5.u.c.o.m
17.PCl5、CH4、NaOH;Na2O2、MgF2
18. (1)镁、铝、氯、碳;
(3)Al3++3OH-===Al(OH)3↓;Al(OH)3+OH-==AlO2-+2H2O。
19.(1)C、D
(2)②;①③ (3) ; (4)KO2(其它合理的化学式也同样给分)。
; (4)KO2(其它合理的化学式也同样给分)。
 w.w.w.k.s.5.u.c.o.m
w.w.w.k.s.5.u.c.o.m
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com