
题目列表(包括答案和解析)

| 实验编号 | ① | ② | ③ | ④ |
| 稀硝酸体积/mL | 100 | 200 | 300 | 400 |
| 剩余金属质量/g | 9.0 | 4.8 | 0 | 0 |
| NO体积/L | 1.12 | 2.24 | 3.36 | V |
为探索工业含铝、铁、铜合金废料的再利用,甲同学设计的实验方案如下: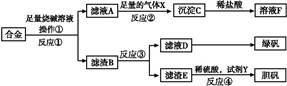
请回答:
(1)操作①用到的玻璃仪器有 。
(2)写出反应①的化学方程式: ,反应②的离子反应方程式: 。
(3)设计实验方案,检测滤液D中含有的金属离子(试剂自选) 。
(4)在滤渣E中加入稀硫酸和试剂Y制胆矾晶体是一种绿色化学工艺,试剂Y为无色液体,反应④的总化学方程式是 。
(5)乙同学在甲同学方案的基础上提出用滤渣B来制备FeCl3·6H2O晶体,在滤渣中滴加盐酸时,发现反应速率比同浓度盐酸与纯铁粉反应要快,其原因是 。
将所得氯化铁溶液用加热浓缩、降温结晶法制得FeCl3·6H2O 晶体,而不用直接蒸发结晶的方法来制得晶体的理由是 。
(6)将滤渣B的均匀混合物平均分成四等份,分别加入同浓度的稀硝酸,充分反应后,在标准状况下生成NO的体积与剩余金属的质量见下表(设硝酸的还原产物只有NO)。
| 实验编号 | ① | ② | ③ | ④ |
| 稀硝酸体积(mL) | 100 | 200 | 300 | 400 |
| 剩余金属质量(g) | 9.0 | 4.8 | 0 | 0 |
| NO体积(L) | 1.12 | 2.24 | 3.36 | V |
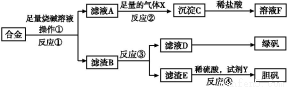
为探索工业含铝、铁、铜合金废料的再利用,甲同学设计的实验方案如下:
请回答:
(1)操作①用到的玻璃仪器有 。
(2)写出反应①的化学方程式: ,反应②的离子反应方程式: 。
(3)设计实验方案,检测滤液D中含有的金属离子(试剂自选) 。
(4)在滤渣E中加入稀硫酸和试剂Y制胆矾晶体是一种绿色化学工艺,试剂Y为无色液体,反应④的总化学方程式是 。
(5)乙同学在甲同学方案的基础上提出用滤渣B来制备FeCl3·6H2O晶体,在滤渣中滴加盐酸时,发现反应速率比同浓度盐酸与纯铁粉反应要快,其原因是 。
将所得氯化铁溶液用加热浓缩、降温结晶法制得FeCl3·6H2O 晶体,而不用直接蒸发结晶的方法来制得晶体的理由是 。
(6)将滤渣B的均匀混合物平均分成四等份,分别加入同浓度的稀硝酸,充分反应后,在标准状况下生成NO的体积与剩余金属的质量见下表(设硝酸的还原产物只有NO)。
实验编号 | ① | ② | ③ | ④ |
稀硝酸体积(mL) | 100 | 200 | 300 | 400 |
剩余金属质量(g) | 9.0 | 4.8 | 0 | 0 |
NO体积(L) | 1.12 | 2.24 | 3.36 | V |
则硝酸的浓度为 ;③中溶解铜的质量为 ;④中V= 。
| 实验编号 | ① | ② | ③ | ④ |
| 稀硝酸体积(mL) | 100 | 200 | 300 | 400 |
| 剩余金属质量(g) | 9.0 | 4.8 | 0 | 0 |
| NO体积(L) | 1.12 | 2.24 | 3.36 | V |
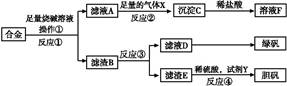
为探索工业含铝、铁、铜合金废料的再利用,某同学实设计的实验方案如下:
(1)操作①用到的玻璃仪器有_______________________________________;
(2)写出反应①的化学方程式_______________________________________;
反应②的离子方程式___________________________________________;
(3)设计实验方案,检测滤液D中含有的金属离子(试剂自选)__________;
(4)在滤渣E中加入稀硫酸和试剂Y制胆矾晶体是一种绿色化学工艺,试剂Y为无
色液体,反应④的总化学方程式是______________________________________;
(5)将滤渣B的均匀混合物平均分成四等份,每份13.2g,分别加入同浓度的稀硝酸,充分反应后,在标准状况下生成NO的体积与剩余金属的质量见下表(设硝酸的还原产物只有NO)。
| 实验编号 | ① | ② | ③ | ④ |
| 稀硝酸体积/mL | 100 | 200 | 300 | 400 |
| 剩余金属质量/g | 9.0 | 4.8 | 0 | 0 |
| NO体积/L | 1.12 | 2.24 | 3.36 | V |
试通过计算填空:
①写出实验①中发生反应的离子方程式__________________________;
②实验④中V=____________________________。
一、选择题(每小题4分,共60分)
题号
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
答案
D
D
B
C
C
B
A
C
D
C
C
B
D
B
A
二、选择题(每小题4分,选对但不全得2分,共28分)
题号
16
17
18
19
20
21
22
答案
AC
BCD
BD
A
AD
D
BCD
23.(1)①较大(2分) ②30 (2分)
(2)①
.files/image337.jpg)
③.files/image339.gif) (2分)
(2分)
24.(16分)解:
(1)小球恰能在A点沿轨道运动时:
.files/image341.gif) (2分)
(2分)
此时,小球在.files/image191.gif) 点动能最小,由机械能守恒:
点动能最小,由机械能守恒:
.files/image344.gif) (2分)
(2分)
解得:
.files/image346.gif) (1分)
(1分)
(2)在.files/image191.gif) 点:
点:.files/image349.gif) (2分)
(2分)
在.files/image193.gif) 点:
点:.files/image352.gif) (2分)
(2分)
小球从A到B机械能守恒:
.files/image354.gif) (2分)
(2分)
两点的压力差:.files/image356.gif) (1分)
(1分)
(3)由图象知:
截距:.files/image358.gif)
.files/image360.gif) (2分)
(2分)
斜率:.files/image362.gif)
.files/image364.gif) (2分)
(2分)
25.(18分)解:
(1)当线框下降.files/image176.gif) 过程中,对线框和物快组成的整体,由动能定理得
过程中,对线框和物快组成的整体,由动能定理得.files/image367.gif) (3分)
(3分)
.files/image369.gif) (2分)
(2分)
(2)线框以I区进入Ⅱ区过程中
.files/image371.gif) (2分)
(2分)
.files/image373.gif)
.files/image375.gif) (3分)
(3分)
(3)线框.files/image218.gif) 边运动到
边运动到.files/image240.gif) 位置之前,只有
位置之前,只有.files/image218.gif) 边从
边从.files/image226.gif) 位置下降2
位置下降2.files/image176.gif) 的过程产生感应电流,设线框
的过程产生感应电流,设线框.files/image218.gif) 边在Ⅱ区域匀速运动的速度是
边在Ⅱ区域匀速运动的速度是.files/image383.gif) ,线圈中电流为
,线圈中电流为.files/image385.gif) ,则
,则
.files/image387.gif) (1分)
(1分)
此时.files/image389.gif) 均做匀速运动
均做匀速运动
.files/image391.gif) (1分)
(1分)
.files/image393.gif) (2分)
(2分)
根据能量转化与守恒定律
.files/image395.gif) (3分)
(3分)
或.files/image397.gif)
.files/image399.gif) (1分)
(1分)
26.(15分)
(1)①
.files/image401.jpg)
②常染色体上的显性遗传(2分) AA或Aa(1分)
.files/image403.gif) (2分)
(2分)
③G-C突变成A-T(2分) 减少(1分)
(2)①父亲的21号染色体在减数第一次分裂中未发生正常分离或在减数第二次分裂中没有分别移向两极(2分)
②适龄生育和产前胎儿细胞的染色体分析(1分)
(3)人体患病也是人体所表现出来的性状,而性状是由基因控制的,所以说疾病都是
基因病,是有一定道理的;然而,这种观点过于绝对化,人类的疾病并不都是由基因的缺陷或改变引起的,也可能是外界环境因素造成的,如由大肠杆菌引起的腹泻,就不是基因病。 (2分)
27.(18分)
(1)①光反应(1分) 色素的数量(1分)
.files/image405.gif) (1分) 光照强度(1分)
(1分) 光照强度(1分)
②白天增加光照强度和夜间适当减低温室内的温度(2分) 因为在该光照强度以下增加光照强度可提高光合作用强度;低温时呼吸速率低(2分)
(2)(2分)
.files/image407.jpg)
(3)植株过密,叶片接受光照不足、通风不良,影响叶绿体进行光合作用;植株过密,单位空间中的线粒体多,细胞呼吸强度增加.结果造成小麦果实中积累的有机物不增加或增加很、或减少.(2分)
(4)步骤一:将提取的完整线粒体和叶绿体悬浮液,分别加入盛有丙铜溶液和.files/image253.gif) 溶液的两支大小相同编号为1、2的试管中,经予充足光照.(2分)
溶液的两支大小相同编号为1、2的试管中,经予充足光照.(2分)
步骤二:分别用澄清的石灰水和点燃的卫生香检验1号和2号试管中产生的气体(2分)
实验现象:1号试管产生的气体使澄清的石灰水变浑浊,2号试管产生的气体使点燃的卫生香燃烧更猛烈(1分)
实验结论:线粒体内发生细胞呼吸过程产生.files/image011.gif) ,叶绿体内发生光合作用产生
,叶绿体内发生光合作用产生.files/image053.gif) 。(1分)
。(1分)
28.(13分)
(1).files/image412.jpg) (2分)
(2分)
(2).files/image414.jpg) (2分)
(2分)
(3).files/image416.gif) (2分)
(2分)
(4).files/image418.gif) (2分)
(2分)
(5).files/image270.gif) (2分) 大于(2分)
(2分) 大于(2分)
29.(16分)
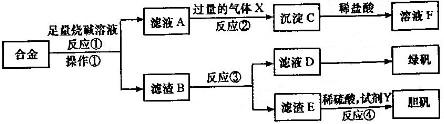
(1)烧杯、漏斗、玻璃棒(2分)
(2)①.files/image421.gif) (2分)
(2分)
②.files/image423.gif) (2分)
(2分)
(3)取少量滤液D加入.files/image063.gif) 溶液,产生白色沉淀,沉淀迅速变成灰绿色,最后变成红褐色(2分,其他合理答案同样得分)
溶液,产生白色沉淀,沉淀迅速变成灰绿色,最后变成红褐色(2分,其他合理答案同样得分)
(4).files/image426.gif)
或.files/image428.gif) (3分)
(3分)
(5).files/image430.gif) (3分)
(3分)
30.(13分)
(3).files/image432.gif) (2分)
(2分)
(5)反应后的气体中碳、氧原子的物质的量之比为2:3,与二氧化碳种碳、氧原子的物质的量比不相符(3分)
(6)CO和CO.files/image005.gif) (2分)
(2分) .files/image435.gif) (3分)
(3分)
(7)在原装置最后连接上C装置(3分)
【选做部分】
31.(8分)[化学――化学与技术]
(1).files/image437.gif) (2分)
(2分)
(2)C (1分)
(3)AB(2分)
(4)氨水 (1分)
.files/image439.gif) (写
(写.files/image441.gif) 也可)(2分)
也可)(2分)
32.(8分)[化学――物质结构与性质]
(1).files/image443.gif) (2分)
(2分)
(2)F>N>0(1分)
(3)2(1分)
(4)原子(1分)大 (1分)
(5)HF分子之间可以形成氢键从而使熔沸点升高。(2分)
33.(8分)[化学――有机化学基础]
(1).files/image445.gif) (2分)
(2分)
(2).files/image447.jpg)
(3)消去反应(1分) 氧化反应(1分)
(4).files/image449.jpg) (2分)
(2分)
34.(8分)[生物技术实践]
(1)蛋白酶 蛋白酶和脂肪酶 加酶和适当提高温度 没有差异,因为高温使酶失活
(2)固定话酶 (3)平板划线法(或稀释涂布平板法) 纤维素
(4)萃取法、蒸馏法、压榨法(任选两种)
35.(8分)[现代生物科技]
(1)限制酶、NDA连接酶 基因重组或重组DNA
(2)第一步 从转基因棉花细胞内提取 mRNA,用标记的目的基因作探针与mR-NA杂交,如果显示出杂交带,则表明目的基因转录出了mRNA。
(3)脱分化 愈伤组织 胚状体、不定芽、顶芽和腑芽等
(4)将目的基因导入叶绿体基因组或线粒体基因组中
36.(8分)(1)A(2分) (2)吸收(3分)
(3).files/image451.gif) (3分)
(3分)
37.(8分)(1)1,沿.files/image188.gif) 轴负方向 (2)
轴负方向 (2).files/image454.gif) ,15(每空2分)
,15(每空2分)
38.(8分)(1)BC (2).files/image456.gif) (每空4分)
(每空4分)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com