
题目列表(包括答案和解析)
某学习小组在用稀硫酸与锌制取氢气的实验中,发现加入少量硫酸铜溶液可加快氢气的生成速率。为了进一步研究硫酸铜的量对氢气生成速率的影响,该小组同学开始了实验探究。
⑴实验方案:将表中所给的混合溶液分别加入到6个盛有过量Zn粒的锥形瓶中,收集产生的气体。记录单位时间氢气产生的体积。
| 实验混合溶液 | A | B | C | D | E | F |
| 4mol/LH2SO4/mL | 30 | V1 | V2 | V3 | V4 | V5 |
| 饱和CuSO4溶/mL | 0 | 0.5 | 2.5 | 5 | V6 | 20 |
| H2O/mL | V7 | V8 | V9 | V10 | 10 | 0 |
其中:V1= ,V6= ,V9= ;
⑵实验装置:甲同学拟选用下列实验装置完成实验:
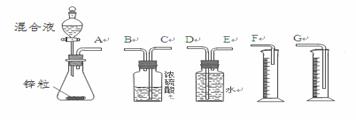
①你认为最简易的装置其连接顺序是:A接( )( )接( )( )接( )(填接口字母,可不填满。)
②实验开始时,先打开分液漏斗上口的玻璃塞,再轻轻打开其活塞,一会儿后稀硫酸就不能顺利滴入锥形瓶。请你帮助分析原因 。
③实验最后,在读取测量实验中生成氢气的总体积时,你认为合理的是 。
A.待实验装置冷却后再读数
B.上下移动量筒F,使其中液面与广口瓶中液面相平
C.上下移动量筒G,使其中液面与广口瓶中液面相平
D.视线与凹液面的最低点水平读取量筒中水的体积
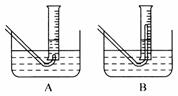 ④ 乙同学认为可选用右图装置中的_____(填A或B)直接与锥形瓶的导管A相连用以测量氢气的体积,理由是 ;实验结束时量筒内的液面高于水槽中液面,立即读数会使氢气的总体积 (填“偏大”“偏小”或“不变”);应进行的操作是 ;
④ 乙同学认为可选用右图装置中的_____(填A或B)直接与锥形瓶的导管A相连用以测量氢气的体积,理由是 ;实验结束时量筒内的液面高于水槽中液面,立即读数会使氢气的总体积 (填“偏大”“偏小”或“不变”);应进行的操作是 ;
⑶实验现象与结论:反应一段时间后,实验A中的金属呈 色,实验E中的金属呈 色;该学习小组最后得出的结论为:当加入少量CuSO4溶液时,生成氢气的速率会大大提高。但当加入的CuSO4溶液超过一定量时,生成氢气的速率反而会下降。请分析氢气生成速率下降的主要原因 。
⑷问题讨论:实验室中现有![]() 、
、![]() 、
、![]() 、
、![]() 等4种溶液,可与实验中
等4种溶液,可与实验中![]() 溶液起相似作用的是 ;要加快上述实验中气体产生的速率,还可采取的措施有 (答两种);
溶液起相似作用的是 ;要加快上述实验中气体产生的速率,还可采取的措施有 (答两种);
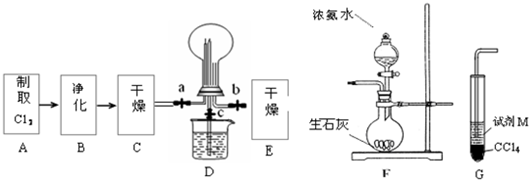

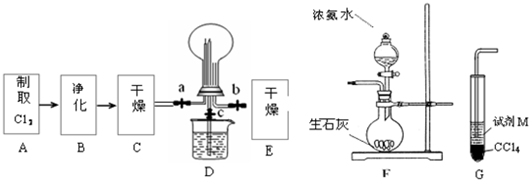

(1)某化学兴趣小组的同学进行Cl2、NH3的制备、性质等实验的流程和部分装置如下:
①请利用A、G装置设计一个简单的实验验证Cl2、Fe3+、I2 的氧化性强弱为Cl2>Fe3+>I2(实验中不断小心振荡G装置中的试管)。请回答A中发生反应的离子方程式 ,试剂M为 溶液,证明氧化性为Cl2>Fe3+>I2的 实验现象是 ;
②已知3Cl2 +2 NH3 = 6HCl + N2 ,当D的烧瓶中充满黄绿色气体后,关闭a、c打开b ,D中的现象为 ,反应一段时间后,关闭b打开c,观察到的现象为 ;
③为使实验顺利进行,请简述F中的分液漏斗的正确操作方法 ;
(2)某废水中含有一定量的Na+、SO32-,可能含有CO32-,某研究小组欲测定其中SO32-离子的浓度,设计如下实验方案:
①从下列试剂中选择试剂x为 (填序号):
A.0.1 mol·L-1 KMnO4(H2SO4酸化)溶液 B.0.5 mol·L-1 1NaOH溶液
C.新制氯水 D.KI溶液
②加入试剂x生成SO42-的离子方程式为 ;
③第ⅲ步的“系列操作”包含的操作名称为 、 、 ;
④证明该废水中是否含有CO32-的实验方案为 。
(15分)
(1)某化学兴趣小组的同学进行Cl2、NH3的制备、性质等实验的流程和部分装置如下: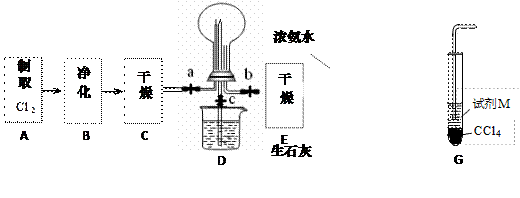
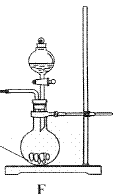
①请利用A、G装置设计一个简单的实验验证Cl2、Fe3+、I2 的氧化性强弱为Cl2>Fe3+>I2(实验中不断小心振荡G装置中的试管)。请回答A中发生反应的离子方程式 ,试剂M为 溶液,证明氧化性为Cl2>Fe3+>I2的 实验现象是 ;
②已知3Cl2 +2 NH3 =" 6HCl" + N2 ,当D的烧瓶中充满黄绿色气体后,关闭a、c打开b ,D中的现象为 ,反应一段时间后,关闭b打开c,观察到的现象为 ;
③为使实验顺利进行,请简述F中的分液漏斗的正确操作方法 ;
(2)某废水中含有一定量的Na+、SO32-,可能含有CO32-,某研究小组欲测定其中SO32-离子的浓度,设计如下实验方案: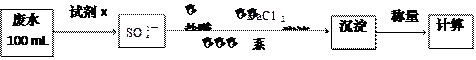
①从下列试剂中选择试剂x为 (填序号):
A.0.1 mol·L-1 KMnO4(H2SO4酸化)溶液 B.0.5 mol·L-1 1NaOH溶液
C.新制氯水 D.KI溶液
②加入试剂x生成SO42-的离子方程式为 ;
③第ⅲ步的“系列操作”包含的操作名称为 、 、 ;
④证明该废水中是否含有CO32-的实验方案为 。
一、选择题(共78分,每小题6分,每小题只有1个选项符合题意)
1―5ADDCB 6―10CBADB 11―13DCA
二、选择题(本题包括8小题,每小题6分,共48分。在每小题给出的四个选项中,有的小题只有一个选项正确,有的小题有多个选项正确,全部选对的得满分,选不全的得一半分,有选错或不选的得0分)
14.C 15.B 16.A 17.BC 18.BD 19.C 20.ACD 21.ABC
第II卷(非选择题 共174分)
22.(1)(4分)2.720 17.8
(2)(4分)50 51.3
(3)(10分) ①CADBFE ②2000 偏小 ③串联 28000
评分标准:本题共18分,(1)问共4分,每空2分;(2)问4分,每空2分;(3)问10分,每空2分
23.解:设子弹水平射入滑块后的共同速度为v0,由动量守恒定律得:
 ①
①

子弹与滑块从A点飞出做平抛运动,若直接落在地面上,落地点与A点的水平距离
 ②
②
斜面底宽 ③
③
子弹与滑块离开A点后不会落到斜面,因此落地时间即为平抛运动时间
所以 ④
④
评分标准:本题共16分,①、②、③、④式各给4分。说明:没有判断子弹与滑块离开A点后不会落到斜面,不给②、③式的8分。
24.解:物块在水平电场中所受电场力:
(1)在3s~5s物块在电场力F作用下由B点匀加速直线运动到A点,
设加速度为a,AB间的距离为S,则
 ①
①
 ②
②

 ③
③

(2)设整个过程中电场力F所做功为WF,物块回到A点的速度为vA,
由动能定理得:
 ④
④
 ⑤
⑤


评分标准:本题共18分,(1)问8分,正确得出①、②、③式各给2分,正确得出 给2分;(2)问10分,正确得出④式给4分,正确得出⑤工给2分,正确得出
给2分;(2)问10分,正确得出④式给4分,正确得出⑤工给2分,正确得出 给4分。
给4分。
25.解:(1)设金属棒 ,由机械能守恒定律得:
,由机械能守恒定律得:
 ①
①
 ②
②
(2)设两金属棒的最终速度为v,由动量守恒定律得:
 ③
③
 ④
④
(3)由能量守恒定律得:
 ⑤
⑤
 ⑥
⑥
评分标准:本题共20分,(1)问6分,正确得出①、②式各给3分;(2)问6分,正确得出③、④式各给3分;(3)问8分,正确得出⑤、⑥式各给4分。
26.(12分,每空2分)
(1)0.25mol?L-1?min-1 >
(2)Fe (填元素符号或名称均可) O2+2H2O+4e-=4OH-
(3)①>②>④>③ 1/2
27.(17分,方程式每空3分,其余每空2 分)
(1)碱石灰 H、J(多选或错选不得分)
(2)先将A、F装置中分液漏斗顶端的盖子打开,再缓缓打开分液漏斗的旋塞,使分液漏斗中的液体缓慢下滴。
|