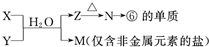
如图是某有色金属冶炼厂以某铜矿石(主要成分为Cu
2S,且含有Fe、Zn硫化物)为原料冶炼铜的工艺流程,其冶炼过程中铜、硫回收率达到97%、87%.

(1)冶炼精铜矿制粗铜的主要反应方程式为
,从提高资源利用率和减排考虑,烟气中的主要废气可综合利用其制备
.
(2)以硫酸铜溶液为介质电解精炼铜时,阴极上的电极反应式为
;电解过程中,硫酸铜溶液的浓度会
(填“变大”“不变”或“变小”).
(3)在精炼铜的过程中,电解质溶液中c(Fe
2+)、c(Zn
2+) 会逐渐增大而影响进一步电解.几种物质的溶度积常数(K
sp)如下:
| 物质 |
Fe(OH)2 |
Fe(OH)3 |
Zn(OH)2 |
Cu(OH)2 |
| Ksp |
8.0×10-16 |
4.0×10-38 |
3.0×10-17 |
2.2×10-20 |
①调节电解液的pH是除去杂质离子的常用方法.根据上表中溶度积数据判断,含等物质的量浓度 Fe
2+、Zn
2+、Fe
3+、Cu
2+的溶液,随pH升高最先沉淀下来的离子是
.
②一种方案是先加入过量的H
2O
2,再调节pH到4左右,加入H
2O
2后发生反应的离子方程式为
.
(4)为测定某铁铜合金组成比例,某同学将一定量该合金样品与某浓度的稀硝酸反应,当加入硝酸10mL,剩余金属1.8g,生成NO(标况)0.224L;再加入硝酸10mL,剩余金属0.96g,又生成NO(标况)0.224L;此时溶液中的金属离子是
,继续加入硝酸10mL,金属恰好全部溶解,又生成NO(标况)0.224L;则该合金中铁铜的物质的量之比为
.

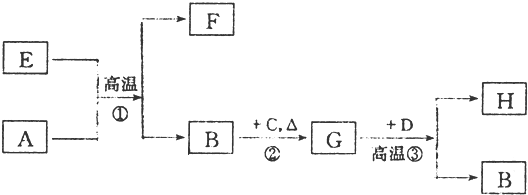
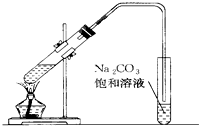 如图是实验室制取乙酸乙酯的装置.
如图是实验室制取乙酸乙酯的装置.
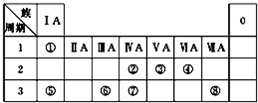 如图为元素周期表的一部分,请参照元素①~⑧在表中的位置,回答下列问题:
如图为元素周期表的一部分,请参照元素①~⑧在表中的位置,回答下列问题: