
题目列表(包括答案和解析)
下图所示装置是用于气体制备、干燥、性质验证、尾气处理的部分仪器装置(加热及夹持固定装置均已略去).请根据下列要求回答问题.

(1)若烧瓶中盛装Zn片,分液漏斗中盛装稀H2SO4,则:
①当制备H2、验证H2的还原性并检验H2的氧化产物,仪器连接顺序为:A→C→B→B→D时,两次使用B装置,其中所盛的药品依次是________、________(写化学式);D装置的作用是________________.
②上述实验中为了使H2产生的速率不至于过快,在不改变现有药品的条件下,可采取的方法有________________、________________.(要求:写出的两种方法原理不同)
(2)若烧瓶中盛装Na2O2,分液漏斗中盛装浓氨水,则:
①烧瓶内除了能产生O2外,还能产生大量NH3.能产生大量NH3的原因是:
a________________;b________________;c________________.
②用产生的气体做氨的催化氧化实验,各仪器装置按气流方向(从左到右)连接顺序是:________→________→________→________(填正确序号的字母)此时在其中的一个装置中可能会出现大量红棕色气体,该装置是________(用字母表示);用化学方程式解释红棕色气体产生的原因:________、________.
(14分)下图所示装置是用于气体制备、干燥、性质验证、尾气处理的部分仪器装置(加热及夹持固定装置均已略去)。请根据下列要求回答问题。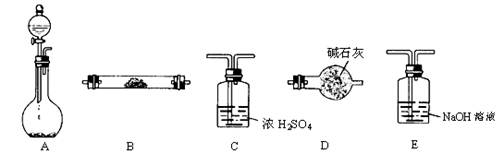
(1)若烧瓶中盛装Zn片,分液漏斗中盛装稀H2SO4,则:
①当制备H2、验证H2的还原性并检验H2的氧化产物,仪器连接顺序为:A→C→B
→B→D时,两次使用B装置,其中所盛的药品依次是 、
(写化学式);D装置的作用是
。
②上述实验中为了使H2产生的速率不至于过快,在不改变现有药品的条件下,可采取的方法有 、
。(要求:写出的两种方法原理不同)
(2)若烧瓶中盛装Na2O2,分液漏斗中盛装浓氨水,则:
①烧瓶内除了能产生O2外,还能产生大量NH3。能产生大量NH3的原因是:
a ;b ;c 。
②用产生的气体做氨的催化氧化实验,各仪器装置按气流方向(从左到右)连接顺序是:A→ → → (填正确序号的字母)此时在其中的一个装置中可能会出现大量红棕色气体,该装置是 (用字母表示);用化学方程式解释红棕色气体产生的原因: 、
。



 25、(14分,每空2分) (1)CaCl2 ;
(2)
; S=C=S; H2S
25、(14分,每空2分) (1)CaCl2 ;
(2)
; S=C=S; H2S
(3)Si3N4 (4)
26、(15分,每空3分)(1)① 800 ② = (2)1.60NA(或1.6NA), 173.4
(3)MFe2Ox+SO2 MFe2O4+S
MFe2O4+S
27、(14分,方程式2分,其它每空1分)(1)① CuO、 CuSO4; 防止空气中的水进入装置,干扰H2氧化产物的检验。
② 控制分液漏斗的活塞,使稀H2SO4缓慢滴下; 加水(或将烧瓶放入冰水中或用冰毛巾捂着烧瓶或加入醋酸钠固体等)(其他合理答案亦可给分)
(2)①Na2O2与水反应放热,降低NH3的溶解度(或使NH3?H2O发生分解);
Na2O2与水反应,耗水(或使水量减少),降低NH3的溶解量; Na2O2与水反应生成OH?,c
OH?)增大,抑制NH3?H2O的电离有利于NH3的逸出。
 ②A→D→B→E(或D)(顺序错不得分), B
②A→D→B→E(或D)(顺序错不得分), B
4NH3+5O2 ===== 4NO+6H2O 、 2NO+O2===2NO2
选做题
33、(15分)(1)压强一定时,温度升高,SO2转化率下降,说明升温有利逆反应的进行,所以正反应为放热反应;(3分)
(2)增大压强对提高SO2转化率无显著影响,反而会增加成本;(2分)
(3)否(2分) 否(2分) (4)浓硫酸(2分)
(5) 8×
34、(15分)(1)1s22s22p6
(3分) (2) (2分),
(2分), (2分)
(2分)
(3)小(2分), b(2分) (4)Cu(2分), 6(2分)
35、(15分)(1)3(2分) (2)②取代反应(或水解反应)(2分) ⑥加成反应(2分)
(3)CH2=CH2(2分),  (2分),
(2分),  (2分)
(2分)
(4)7(2分) (5)m:(m+n):n(1分)
生物参考答案:
选择题:1.D 2.B 3.A 4.C 5.D 6.C
28.(16分,每空1分)I.(1)叶绿体 CO2 +
H2O  (CH2O)+ O2 色素的数量不足 CO2供应量不足
(2)丙酮酸 细胞质基质 (3)[E]水 (4)调节温度,增大昼夜温差 大于
(CH2O)+ O2 色素的数量不足 CO2供应量不足
(2)丙酮酸 细胞质基质 (3)[E]水 (4)调节温度,增大昼夜温差 大于
Ⅱ.(1)胰高血糖素 肾上腺素 胰岛素 浆细胞 (2)肝脏、肌肉 (3)生产者 生产者、消费者、分解者
29.(23分) I.(10分,每空1分)(1)有遗传效应的DNA片段 常 Aa 1/100
(2)碱基序列 胞嘧啶脱氧核苷酸突变成了胸腺嘧啶脱氧核苷酸 (3)限制酶(限制性内切酶);运载体(或质粒) (4)29 (5)基因突变、基因重组、染色体变异
Ⅱ.(13分)①斐林试剂(班氏试剂)(1分) 葡萄糖是还原糖,加热可被斐林试剂(或班氏试剂)氧化生成砖红色沉淀(1分) ②血液呈红色,若直接用斐林试剂(或班氏试剂)检测葡萄糖,则产生的现象受到干扰,而尿液颜色则不干扰显色反应(2分) ③步骤1:取加有柠檬酸钠的鸡血5mL,用离心机离心,获取上清液(2分) 步骤2:取2mL上清液,加入(新配制)的斐林试剂(或班氏试剂)1mL,摇匀后水浴加热,一段时间后观察现象(2分) 现象:有砖红色沉淀(1分) ④现象1:有砖红色沉淀出现 结论1:尿液中有葡萄糖(2分) 现象2:没有砖红色沉淀出现 结论1:尿液中无葡萄糖(2分)
 36.(选修1)(15分)(1)酵母菌的分离(2分) 选择培养基(2分) (2)中和发酵时产生的酸类物质(2分) (3)在无氧条件下,酵母菌进行酒精发酵(2分) (4)异养需
36.(选修1)(15分)(1)酵母菌的分离(2分) 选择培养基(2分) (2)中和发酵时产生的酸类物质(2分) (3)在无氧条件下,酵母菌进行酒精发酵(2分) (4)异养需
氧(2分) 醋酸菌(1分)
30
37.(选修3)(15分)(1)不仅可以保持优良品种的遗传特性,还可以高效快速地实现种苗的大量繁殖(2分) (2)无病毒(2分) (3)D (1分) (4)三只小羊是由同一个重组细胞发育而成的(2分) (5)DNA分子杂交(基因探针)(2分) (6)该时期的细胞分化程度低,全能性高(2分) 卵母细胞的采集(2分) 精子的获取(2分)
物理参考答案:
14、CD 15、B 16、C 17、BD 18、C 19、B 20、C 21、D
22、Ⅰ 1.901 2.540 (每空3分)
Ⅱ 图6分
 |
②mA表内阻RA= 80  。(74Ω~82Ω均算正确)(3分)
。(74Ω~82Ω均算正确)(3分)
23、解:设m在1/4圆形轨道最低点速度为v,由牛顿运动定律
N-mg=mv2/R ……..4分
在下滑过程中克服摩擦力做功为W,由动能定理:
mv2/2=mgR-W ………4分
所以 W=mgR- mv2/2=mgR/2 ………2分
在水平轨道上物体以速度v做匀减速运动直至停止,则:
0- mv2/2= -μmgx ……….3分
物体在水平轨道上滑行距离: x=R/2μ ……..2分
24、解:微粒受力分析如图所示,
 由题意得:qE =mg=1×10-2N
由题意得:qE =mg=1×10-2N
合力F= ×10-2N 方向沿MO方向
×10-2N 方向沿MO方向
故微粒由静止做匀加速直线运动, ……..2分
则第一次到达X轴时的坐标位置为(0,0)m …….3分
设此时速度为v,则由牛顿运动定律:
F=ma
v2=2ax=2Fx/m=2× ×10-2×
×10-2× ×10-1/10-3=4
×10-1/10-3=4
得:第一次到达X轴时的速度v=
微粒在X轴下方区域,重力与电场力平衡,故微粒做匀速圆周运动,设轨迹半径为r,周期为T,由右图中几何关系可得,转过的圆心角为270°, …….2分
则:
qvB= mv2/r
所以 r/v=m/qB …….2分
T=2πr/v=2πm/qB …….2分
所以再次通过X轴时到O点距离为
 x1=
x1= r=
r= mv/qB=
mv/qB= ×10-1
×10-1
该点坐标为( ×10
×10
微粒在X轴下方运动时间为t=3T/4,代入数值得:
t=0.075πs (约0.24s) …….2分
30、(1)AD
(2)球体,单分子,直径(每空1分)
(3)1.2×10-5 , 5×10-10(每空3分)
31、(1)C
(2)f1=2.5Hz f2=7.5Hz (4分) v1=
32、(1)中子,正电子 (每空3分)
(2)解:由图象可知,m1碰前速度v1=
m2碰前速度v2=0,碰后的速度v2/=
质量为m1的物体在碰撞过程中动量的变化量是:
 -----------------2分
-----------------2分
(2)由动量守恒定律得:m1v1+m2v2=m1v1/+m2v2/ ---------------2分
带入数据解得:m2=
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com