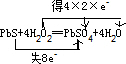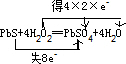工业上制氯化铜无水物时,是将浓盐酸用蒸气加热至80℃左右,慢慢加入粗制氧化铜粉(含杂质氧化亚铁和SiO
2),充分搅拌后使之溶解,制取流程如下:
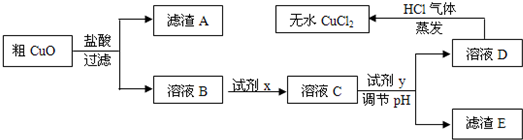
已知:pH≥9.6时,Fe
2+以Fe(OH)
2的形式完全沉淀;pH≥6.4时,Cu
2+以Cu(OH)
2的形式完全沉淀;常温时K
sp[Fe(OH)
3]=c(Fe
3+).c
3(OH
-)=1.0×10
-38.试回答:
(1)根据常温时Fe(OH)
3的K
sp计算,当溶液中的Fe
3+完全沉淀(此时溶液中的Fe
3+物质的量的浓度=10
-5mol/L),溶液的pH=
3
3
.
(2)溶液D制取无水CuCl
2时,需在HCl气体中蒸干,原因是
HCl抑制CuCl2水解
HCl抑制CuCl2水解
.
(3)粗CuO溶于过量盐酸后,得到的溶液B中加入试剂x将Fe
2+氧化为Fe
3+,试剂x可以是
BD
BD
(填以下选项序号).
A.KMnO
4溶液 B.氯水 C.NaClO溶液 D.O
3若用H
2O
2溶液,则反应的离子方程式为
2Fe2++H2O2+2H+=2Fe3++2H2O
2Fe2++H2O2+2H+=2Fe3++2H2O
.
(4)溶液C加入试剂y,要调整溶液的pH至3-4,试剂y不能是
A
A
(填以下选项序号),原因是
将引入新杂质NaCl
将引入新杂质NaCl
.
A.NaOH溶液 B.Cu(OH)
2固体 C.Cu
2(OH)
2CO
3固体 D.CuO固体
(5)将ag粗CuO经过以上一系列操作之后,最终得到bg无水CuCl
2(不考虑实验过程中操作引起的损耗),下列说法正确的是
ABD
ABD
.(N
A表示阿伏伽德罗常数)
A.粗CuO中Cu
2+数目小于
B.粗CuO中CuO物质的量小于
mol
C.粗CuO中所含的铜元素的质量分数为
x100%
D.粗CuO中关于CuO的量无法确定.

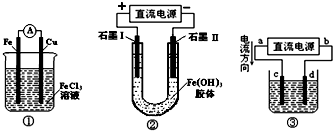 (2012?丹东模拟)关于如图所示各装置的叙述中,正确的是( )
(2012?丹东模拟)关于如图所示各装置的叙述中,正确的是( )