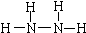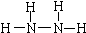
(2013?河西区一模)肼(N
2H
4)和氨是氮的两种常见化合物,在科学技术和生产中有广泛应用.请按要求回答下列问题:
(1)N
2H
4中N原子核外最外层达到8电子稳定结构.写出N
2H
4的结构式:
.
(2)实验室用两种固体制取NH
3的反应化学方程式为
2NH
4Cl+Ca(OH)
2CaCl
2+2H
2O+2NH
3↑
2NH
4Cl+Ca(OH)
2CaCl
2+2H
2O+2NH
3↑
.
(3)NH
3与NaClO反应可得到肼(N
2H
4),该反应的化学方程式为
2NH3+NaClO=N2H4+NaCl+H2O
2NH3+NaClO=N2H4+NaCl+H2O
.
(4)肼一空气燃料电池是一种碱性环保电池,该电池放电时,负极的反应式为
N2H4+4OH--4e-=N2+4H2O
N2H4+4OH--4e-=N2+4H2O
.
(5)工业生产尿素的原理是以NH
3和CO
2为原料合成尿素[CO(NH
2)
2]反应的化学方程式为2NH
3(g)+CO
2(g)?CO(NH
2)
2(l)+H
2O(l),该反应的平衡常数和温度关系如下:
| T/℃ |
165 |
175 |
185 |
195 |
| K |
111.9 |
74.1 |
50.6 |
34.8 |
①焓变△H
<
<
0(填“>”、“<”或“=”).
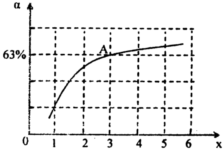
②在一定温度和压强下,若原料气中的NH
3和CO
2的物质的量之比(氨碳比)
=x,如图是氨碳比(x)与CO
2平衡转化率(α)的关系.α随着x增大而增大的原因是
c(NH3)增大,平衡正向移动
c(NH3)增大,平衡正向移动
.图中A点处,NH
3的平衡转化率为
42%
42%
.
(6)在恒温恒容密闭容器中按照甲、乙、丙三种方式分别投料,发生反应:N
2(g)+3H
2(g)?2NH
3(g),测得甲容器中H
2的平衡转化率为40%.
|
n(N2) |
n(H2) |
n(NH3) |
| 甲 |
1mol |
3mol |
0mol |
| 乙 |
0.5mol |
1.5mol |
1mol |
| 丙 |
0mol |
0mol |
4mol |
①判断乙容器中反应进行的方向是
逆向
逆向
(填“正向或“逆向”)移动.
②达平衡时,甲、乙、丙三容器中NH
3的体积分数大小顺序为
甲=乙=丙
甲=乙=丙
.

 (2013?河西区一模)肼(N2H4)和氨是氮的两种常见化合物,在科学技术和生产中有广泛应用.请按要求回答下列问题:
(2013?河西区一模)肼(N2H4)和氨是氮的两种常见化合物,在科学技术和生产中有广泛应用.请按要求回答下列问题: