
题目列表(包括答案和解析)

 已知常温下E为无色无味的液体,F为淡黄色粉末,G为常见的无色气体(反应条件均已略),请回答下列问题:
已知常温下E为无色无味的液体,F为淡黄色粉末,G为常见的无色气体(反应条件均已略),请回答下列问题:

| ||
| ||
(12分)自然界里氮的固定途径之一是在闪电的作用下,N2与O2反应生成NO。
(1)在不同温度下,反应N2(g)+O2(g) 2NO(g) △H=a kJ·mol-1的平衡常数K如下表:
2NO(g) △H=a kJ·mol-1的平衡常数K如下表:
|
温度/℃ |
1538 |
1760 |
2404 |
|
平衡常数K |
0、86×10-4 |
2、6×10-4 |
64×10-4 |
①该反应的△H 0(填“>”、“=”或“<”)。
②其他条件相同时,在上述三个温度下分别发生该反应。1538℃时,N2的转化率随时间变化如图所示,
请补充完成1760℃时N2的转化率随时间变化的示意图。

(2)科学家一直致力于研究常温、常压下“人工固氮”的新方法。曾有实验报道:在常温、常压、光照条件下,N2在催化剂(掺有少量Fe2O3的TiO2)表面与水发生反应,生成的主要产物为NH3。相应的热化学方程式如下:
2N2(g)+6H2O(1) =4NH3(g)+3O2(g) △H=+1530kJ·mol-1
则氨催化氧化反应4NH3(g)+5O2(g) =4NO(g)+6H2O(1) 的反应热△H= 。
(用含a的代数式表示)
(3)最近一些科学家研究采用高质子导电性的SCY陶瓷(能传递H+)实现氮的固定——氨的电解法合成,大大提高了氮气和氢气的转化率。总反应式为:N2+3H2 2NH3。则在电解法合成氨的过程中,应将H2不断地通入
极(填“正”、“负”、 “阴” 或“阳”);在另一电极通入N2,该电极反应式为 。
2NH3。则在电解法合成氨的过程中,应将H2不断地通入
极(填“正”、“负”、 “阴” 或“阳”);在另一电极通入N2,该电极反应式为 。
 (4)合成氨的反应N2(g)+3H2(g)
(4)合成氨的反应N2(g)+3H2(g) 2NH3(g) △H =
-92、4 kJ·mol-1,一定条件下的密闭容器中,该反应达到平衡,要提高N2的转化率,可以采取的措施是__________(填字母代号)。
2NH3(g) △H =
-92、4 kJ·mol-1,一定条件下的密闭容器中,该反应达到平衡,要提高N2的转化率,可以采取的措施是__________(填字母代号)。
a、升高温度 b、加入催化剂 c、增加H2的浓度
d、增加N2的浓度 e、分离出NH3
(5)在25℃下,将a mol·L-1的氨水与0、01 mol·L-1的盐酸等体积混合,反应后溶液中c(NH4+)=c(Cl-),则溶液显_____________性(填“酸”“碱”或“中”), 可推断a 0、01(填大于、等于或小于)。
工业制硝酸的主要反应是:4NH3(g)+5O2(g) 4NO(g)+6H2O
(g) ΔH= -1025 KJ/mol
4NO(g)+6H2O
(g) ΔH= -1025 KJ/mol
(1)一定温度下,现将0.8mol NH3和1.5mol O2充入一恒压密闭容器中,下列示意图正确且能说明反应达到平衡状态的是

(2)在容积为1L的密闭容器中发生上述反应,容器内部分物质的物质的量浓度如下表:
|
时间/浓度 |
c(NH3)(mol/L) |
C(O2)(mol/L) |
C(NO)(mol/L) |
|
起始 |
0.8 |
1.5 |
0 |
|
第2min |
0.7 |
a |
0.1 |
|
第4min |
0.4 |
1.0 |
0.4 |
|
第6min |
0.4 |
1.0 |
0.4 |
|
第8min |
1.2 |
2.5 |
0.4 |
①起始时物料比c (O2) : c (NH3)>1.25,其原因是
②反应在第2min到第4min时O2的平均反应速率为 mol·L-1·min-1
③反应在第2min改变了反应条件,改变的条件可能是 (填字母序号)
a.使用催化剂 b.升高温度 c.增大压强 d.增加O2的浓度
④反应在第8min改变的反应条件可能是 ,再次达到平衡时,NO的体积分数
(填“增大”、“减小”或“不变”)
(8分)混合物平均摩尔质量通常可表示为: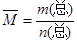 ,利用此概念可以讨论许多化学问题:
,利用此概念可以讨论许多化学问题:
(1)相同条件下,潮湿空气的密度 (选填“>”、“<”或“=”)干燥空气的密度。
(2)在一定条件下的恒容密闭容器中,建立如下平衡:5O2(g)+4NH3(g)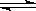 4NO(g)+6H2O(g);假如温度保持不变并充入He,则平衡 (填“正向移动”、“逆向移动”、“不移动”),
4NO(g)+6H2O(g);假如温度保持不变并充入He,则平衡 (填“正向移动”、“逆向移动”、“不移动”),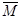 (混合气)将 (填写“变大”、“变小”或“不变”);
(混合气)将 (填写“变大”、“变小”或“不变”);
(3)在一定温度下恒容密闭容器中,当下列物理量不再变化时,不能表明反应:A(s)+2B(g)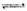 C(g)+D(g)已达平衡的是
C(g)+D(g)已达平衡的是
| A.混合气体的平均相对分子质量 | B.混合气体的密度 |
| C.B的物质的量浓度 | D.气体的总物质的量 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com