
题目列表(包括答案和解析)
一定条件下铁可以和CO2发生反应:
Fe(s)+CO2(g)![]() FeO(s)+CO(g);△H>0
FeO(s)+CO(g);△H>0
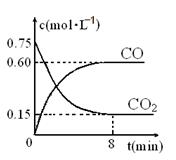
(1)一定温度下,向某密闭容器中加入足量铁粉并充入一定量的CO2气体,反应过程中CO2气体和CO气体的浓度与时间的关系如图所示,求8分钟内CO的平均反应速率v(CO)= 。
(2)下列措施中能使平衡时c(CO)/c(CO2)增大的是 (填序号)。
A.升高温度 B.增大压强 C.充入一定量氮气 D.再加入一些铁粉
(3)反应达到平衡后,若保持容器体积不变时,再通入少量的CO2,则CO2的转化率将
(填“增大”、“减小”、“不变”)
(4)铁的重要化合物在生产生活中应用十分广泛。
①FeSO4溶液与稍过量的NH4HCO3溶液混合,可得含FeCO3的浊液。若FeCO3浊液长时间暴露在空气中,固体表面会变为红褐色,写出由FeCO3生成红褐色物质的反应的化学方程式: 。
②高铁酸钠(Na2FeO4)是一种新型饮用水消毒剂。高铁酸钠生产方法之一是:强碱性溶液中用NaClO氧化Fe(OH)3生成高铁酸钠、氯化钠和另一种常见化合物,该反应的离子方程式为 。
(5)已知:2CO(g) + O2(g) == 2CO2(g);△H=-566 kJ·mol-1
2H2(g) + O2(g) == 2H2O(g);△H=-483.6 kJ·mol-1
写出CO和H2O(g)作用生成CO2和H2的热化学方程式:
。
一定条件下铁可以和CO2发生反应:
Fe(s)+CO2(g)FeO(s)+CO(g);△H>0
(1)一定温度下,向某密闭容器中加入足量铁粉并充入一定量的CO2气体,反应过程中CO2气体和CO气体的浓度与时间的关系如图所示,求8分钟内CO的平均反应速率v(CO)= 。
(2)下列措施中能使平衡时c(CO)/c(CO2)增大的是 (填序号)。
A.升高温度 B.增大压强 C.充入一定量氮气 D.再加入一些铁粉
(3)反应达到平衡后,若保持容器体积不变时,再通入一定量的CO2,则CO2的转化率将 (填“增大”、“减小”、“不变”),该反应的平衡常数K= ,温度升高,K (填“增大”、“减小”、“不变”)。
(4)铁的重要化合物在生产生活中应用十分广泛。高铁酸钠(Na2FeO4)是一种新型饮用水消毒剂。高铁酸钠生产方法之一是:强碱性溶液中用NaClO氧化Fe(OH)3生成高铁酸钠、氯化钠和另一种常见化合物,该反应的离子方程式为 。
(5)已知:2CO(g)+O2(g)==2CO2(g)△H=-566 kJ/mol;2H2(g)+O2(g)==2H2O(g)△H=-483.6 kJ/mol。写出CO和H2O(g)作用生成CO2和H2的热化学方程式 。
(6)已知Ksp(Fe(OH)3)= 8´10-38,某溶液中含有Fe3的浓度是0.05mol×L-1。如果要使Fe(OH)3沉淀完全pH至少为 (溶液中离子浓度小于1×10-5mol/L时,沉淀完全,lg2=0.3)
一定条件下铁可以和CO2发生反应:
Fe(s)+CO2(g)FeO(s)+CO(g);△H>0
(1)一定温度下,向某密闭容器中加入足量铁粉并充入一定量的CO2气体,反应过程中CO2气体和CO气体的浓度与时间的关系如图所示,求8分钟内CO的平均反应速率v(CO)= 。
(2)下列措施中能使平衡时c(CO)/c(CO2)增大的是 (填序号)。
A.升高温度 B.增大压强 C.充入一定量氮气 D.再加入一些铁粉
(3)反应达到平衡后,若保持容器体积不变时,再通入少量的CO2,则CO2的转化率将
(填“增大”、“减小”、“不变”)
(4)铁的重要化合物在生产生活中应用十分广泛。
①FeSO4溶液与稍过量的NH4HCO3溶液混合,可得含FeCO3的浊液。若FeCO3浊液长时间暴露在空气中,固体表面会变为红褐色,写出由FeCO3生成红褐色物质的反应的化学方程式: 。
②高铁酸钠(Na2FeO4)是一种新型饮用水消毒剂。高铁酸钠生产方法之一是:强碱性溶液中用NaClO氧化Fe(OH)3生成高铁酸钠、氯化钠和另一种常见化合物,该反应的离子方程式为 。
(5)已知:2CO(g) + O2(g)== 2CO2(g);△H=-566kJ·mol-1
2H2(g) + O2(g) == 2H2O(g);△H=-483.6kJ·mol-1
写出CO和H2O(g)作用生成CO2和H2的热化学方程式:
。
(13分)一定条件下铁可以和CO2发生反应: Fe(s)+CO2(g)FeO(s)+CO(g);△H>0
(1)一定温度下,向某密闭容器中加入足量铁粉并充入一定量的CO2气体,反应过程中CO2气体和CO气体的浓度与时间的关系如图所示,求8分钟内CO的平均反应速率v(CO)= 。
(2)下列措施中能使平衡时c(CO)/c(CO2)增大的是 (填序号)。
A.升高温度 B.增大压强 C.充入一定量氮气 D.再加入一些铁粉
(3)反应达到平衡后,若保持容器体积不变时,再通入一定量的CO2,则CO2的转化率将 (填“增大”、“减小”、“不变”)
(4)铁的重要化合物在生产生活中应用十分广泛。
①FeCl3溶液可用于天然气脱硫,写FeCl3溶液与天然气中H2S反应的离子方程式:
。
②高铁酸钠(Na2FeO4)是一种新型饮用水消毒剂。高铁酸钠生产方法之一是:强碱性溶液中用NaClO氧化Fe(OH)3生成高铁酸钠、氯化钠和另一种常见化合物,该反应的离子方程式为 。
(5)已知:2CO(g)+O2(g)==2CO2(g) △H=-566 kJ/mol;2H2(g)+O2(g)==2H2O(g) △H=-483.6 kJ/mol。写出CO和H2O(g)作用生成CO2和H2的热化学方程式
。
一定条件下铁可以和CO2发生反应:
Fe(s)+CO2(g) FeO(s)+CO(g);△H>0
FeO(s)+CO(g);△H>0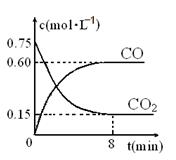
(1)一定温度下,向某密闭容器中加入足量铁粉并充入一定量的CO2气体,反应过程中CO2气体和CO气体的浓度与时间的关系如图所示,求8分钟内CO的平均反应速率v(CO)= 。
(2)下列措施中能使平衡时c(CO)/c(CO2)增大的是 (填序号)。
| A.升高温度 | B.增大压强 | C.充入一定量氮气 | D.再加入一些铁粉 |
6、B 7、C 8、A 9、D 10、B 11、D 12、A 13、C
26 . ( 13 分) ( 1 ) y的电子式:  ( 2 分) 非极性( l 分)
( 2 分) 非极性( l 分)
( 2 ) 87 ( l 分)
( 3 ) C ( 1 分)
( 4 )碱( 1 分) NH3?H2O  NH4+ + OH一(2分)
NH4+ + OH一(2分)
CO32― + H2O  HCO3― + OH一( 2 分)
HCO3― + OH一( 2 分)
( 5 ) 2NH3 一 6e一+ 6OH― == N2 + 6H2O ( 2 分) 减小( 1 分)
27 . ( 16 分)

( 2 ) ① ⑥ (各 1 分,共 2 分。答 ③ 不扣分,其余有错扣 1 分)
( 3 )羟基( l 分)羧基( 1 分)


28 . ( 16 分) ( 1 ) FeS2 ( 2 分) 沸腾炉(1分)
( 2 )氯酸钾(或KClO3)( 1 分) 镁条(或 Mg ) ( 1 分)

防止产生的Cl2和H2混和发生爆炸( l 分),避免Cl2和NaOH反应,使生成的 NaOH不纯( 1 分)
( 4 ) 6Fe2+ +3ClO一+ 3 H2O == 2Fe(OH)3↓+3Cl―+ 4Fe3 + ( 2分)
( 5 ) I.不合理( 1 分),因为 SO2Cl2为液体,移走 SO2Cl2对反应体系中压强和气体浓度的影响不大(或对反应速率和 SO2Cl2的产率影响不大) ( l 分)
II.不合理( 1 分),该反应为放热反应,升高温度会降低 SO2Cl2的产率,但温度过低,反应速率很小,经济效益较低。因此,应选择适当的温度。( 2 分)
29.( 15 分)
( 1 )增大铜粉与氧接触面积, 使反应迅速、充分( 2 分)
( 2 ) N2 ( 1 分),排出 D中的空气(1分) 关闭 k3( 1 分) 打开 kl、 k2 ( 1 分)
( 3 ) 锥形瓶中玻璃管液面上升( 1 分)
( 4 )Cu 十2NO3―+ 4H + === Cu 2+ + 2NO2↑+ 2H2O ( 2 分)
( 5 ) 向下调节量气管(或及时关闭 k3 ) ( 1分,其它合理答案也可给分)
( 6 ) I . 0.0720 mol / L ( 2 分)
II.有( 1 分) E 装置中生成 100 mL 、0.0720 mol / L硝酸时产生的NO 约为 80.6mL, 而试管中原有 50 mL N2,二者之和小于139.00 mL ,说明生成 NO2 的同时有 NO 生成( 2 分)。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com