
题目列表(包括答案和解析)
(08长沙雅礼中学二模)(16分)农民使用的氮肥主要是“氢铵”和尿素。某化学兴趣小组对某“氢铵”化肥进行了专项研究:
(1)预测:根据已有知识和“氢铵”的名称,该小组预测该“氢铵”是碳酸或亚硫酸或硫酸的铵盐。
(2)验证和探究:
①NH4+的验证:取少量固体药品于试管中,然后 __________。
②阴离子的探究:
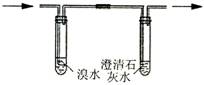 a.取少量固体药品于试管中,然后向试管中滴加稀盐酸,固体全部溶解,将产生的气体通入下列装置。观察到的现象是:溴水无明显变化,澄清石灰水变浑浊。再向滴加稀盐酸反应后的试管中,加Ba(OH)2溶液,无明显现象。
a.取少量固体药品于试管中,然后向试管中滴加稀盐酸,固体全部溶解,将产生的气体通入下列装置。观察到的现象是:溴水无明显变化,澄清石灰水变浑浊。再向滴加稀盐酸反应后的试管中,加Ba(OH)2溶液,无明显现象。
初步结论:“氢铵”是 的铵盐。
b.要进一步确定“氢铵”的成分还需要补做如下实验:取适量“氢铵”配制成溶液,取试液于一支洁净的试管中,加 (写出加入试剂后看到的现象和结论)
(3)该实验小组设计了以下二个实验方案测定该化肥的含氮量,请你阅读后解释方案中提出的问题并进行评价:

方案(一)
准确称取一定质量的样品,放入上图方案(一)的烧瓶中,滴加过量NaOH浓溶液,充分微热,按如图装置,通过实验测定烧杯增加的质量(忽略漏斗中附着溶液的质量)。然后进行计算,可得化肥的含氮量。
方案(二)准确称取一定质量的样品,放入上图方案(二)的烧瓶中,滴加过量NaOH浓溶液,充分微热,按如图装置(A管可以上下移动),测量生成的氨气体积(设所测体积为标准状况下的体积)。然后进行计算,可得化肥的含氮量。
方案(二)
图中导管a的作用是 。
请你评价上述两套方案是否合理。若合理只需要说明结论;若不合理,请简要说明原因,并指出修改方案(若要添加仪器、药品,请说明添加的位置、名称)
方案(一) 。
方案(二) 。
(08浙江省严州中学二模)下列实验中所选用的仪器或操作以及结论不合理的是 。
A、用托盘天平称量11.7g氯化钠晶体
B、用碱式滴定管量取25mL碳酸钠溶液
C、不宜用瓷坩埚灼烧氢氧化钠、碳酸钠
D、测定溶液的pH时,用洁净、干燥的玻璃棒蘸取溶液,滴在用蒸馏水润湿过的pH试纸上,再与标准比色卡比较
E、用蒸馏水和pH试纸,就可以鉴别pH相等的H2SO4和CH2COOH溶液
F、量筒内液体体积正确读数为10.0mL时,全部倒入烧杯内的实际体积10.0mL
G、100mL容量瓶内液面正好达到刻度线,全部倒入烧杯内的实际体积小于100mL
(08长沙雅礼中学二模)下列离子方程式正确的是( )
A.H2O2溶液滴入酸性KMnO4溶液中:2MnO![]() +3H2O2+6H+ === 2Mn2++4O2↑+6H2O
+3H2O2+6H+ === 2Mn2++4O2↑+6H2O
B.等体积等物质的量浓度的AlCl3与NaOH溶液混合:Al3++3OH![]() === Al(OH)3↓
=== Al(OH)3↓
C.等物质的量的Cl2与FeI2的溶液反应:2Cl2+2Fe2++2I![]() === 2Fe3++I2+4Cl
=== 2Fe3++I2+4Cl![]()
D.Fe(OH)3胶体的制取:Fe3++3H2O ![]() Fe(OH)3(胶体)+3H+
Fe(OH)3(胶体)+3H+
| A、有科学家称硅是“21世纪的能源”,这主要是由于作为半导体材料的硅在太阳能发电过程中具有重要的作用 | B、浓硝酸在光照条件下变黄,说明浓硝酸易分解生成有色产物且溶于浓硝酸 | C、漂白粉既可作漂白棉、麻、纸张的漂白剂,又可用作游泳池及环境的消毒刑 | D、铝热反应常被用于野外焊接钢轨,说明铝的氧化性很强 |
| A、自然界中含钾的物质都易溶于水,是因为钾盐溶解度很大 | B、某溶液用盐酸酸化无明显现象,再滴加氯化钡溶液有白色沉淀,说明溶液中有S042- | C、铝热反应常被用于野外焊接钢轨,说明铝的氧化性很强 | D、用浓硫酸与铜在常温下可制取S02,因为浓硫酸具有强氧化性 |
选择题答案表:
题号
1
2
3
4
5
6
7
8
答案
A
C
A
C
C
A
D
D
题号
9
10
11
12
13
14
答案
B
AD
C
D
BD
AD
15、(12分)Ⅰ(4分)①②④⑥
Ⅱ(8分)⑴用冰水冷却有利于析出更多的晶体,黑暗可以防止晶体分解(2分)
⑵过滤、洗涤(1分)
⑶100mL容量瓶、酸式滴定管(2分) (紫)红(1分) ⑷3 (2分)
 16、(8分(1)NaClO(1分)(2)
16、(8分(1)NaClO(1分)(2) (1分)
(1分)
(3)2NaCl +2H2O
 H2↑+ Cl2↑+2NaOH (2分) 氯碱工业(1分)
H2↑+ Cl2↑+2NaOH (2分) 氯碱工业(1分)
(4)2Fe3+ + 3ClO? + 10OH? = 2FeO42? + 3Cl? + 5H2O(2分)
②本身被还原成Fe3+而发生水解生成Fe(OH)3胶体吸附水中杂质以达到净化水的目的。(1分)
17、(10分)(1)FeSO4?7H2O (写FeSO4晶体也给分)
(2)防止Fe2+氧化; 取副产品甲少许溶于水,滴加适量KSCN溶液,观察溶液是否变为血红色。
(3)稀盐酸(或稀硫酸等) (4)TiO2  Ti+O2↑
(每空2分,共10分)
Ti+O2↑
(每空2分,共10分)
18、(10分)⑴2NO3-+5Mg+6H2O==N2↑+5Mg(OH)2+2OH-(2分)
⑵①快速方便易行(2分,相近合理答案也给分)
②空白对照实验(2分,相近合理答案也给分)
③将水样先稀释一定倍数后再重复实验(2分)
⑶ 800 (2分)
19、(12分)(1)加成 (1分)(2)13(2分)
(3)(4分) (4)(5分)
(4)(5分)

20、(10分)⑴ 0.01 mol?L-1(2分) 不变(1分)
⑵ <(2分)
⑶ 设焙烧炉中消耗空气的物质的量为5x,鼓风炉中消耗空气物质的量为5y,则:
 Zn(g)+CO2(g)
Zn(g)+CO2(g)
y 2y 1mol 2y×62.5% 1mol
2y×62.5%=1mol y=0.8mol 5y=4mol(2分)
2ZnS + 3O2 = 2ZnO + 2SO2 △n
2mol 1mol
1mol 0.5mol
4x/(5x-0.5mol)=82.5% x=3.3mol 5x=16.5mol(2分)
5x+5y=4mol+16.5mol=20.5mol
V(空气)=20.5×
 21、(12分)
21、(12分)
(1)CD(2分) (2) H3AsO4(1分);第四周期元素,原子核外只有四个电子层。按能量最低原理,4s上排2个电子,3d上排10个电子,4p上排6个电子,共对应18种元素,若4d排电子,就出现了第五电子层,就不是第四周期元素了,所以第四周期只有18种元素。(2分) (2)+3(1分);正四面体(1分);3d74s2(1分) (3)BC(2分)
(4)N2O或CO2或CS2或BeCl2;SCN-或OCN-(2分)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com