
题目列表(包括答案和解析)
食盐中的抗结剂是亚铁氰化钾,其化学式为K4[Fe(CN)6] ?3H2O。
42.2g K4[Fe(CN)6] ?3H2O样品受热脱水过程的热重曲线(样品质量随温度的变化曲线)如下图所示。试回答下列问题:
(1)试确定150℃时固体物质的化学式为_______________。
(2)查阅资料知:虽然亚铁氰化钾自身毒性很低,但其水溶液与酸反应放出极毒的氰化氢(HCN)气体;亚铁氰化钾加热至一定温度时能分解产生氰化钾(KCN)。据此判断,烹饪食品时应注意的问题为___________________________________。
(3)在25℃下,将a mol?L-1的KCN(pH>7)溶液与0.01mol?L-1的盐酸等体积混合,反应平衡时,测得溶液pH=7,则KCN溶液的物质的量浓度a_______0.01mol?L-1(填“>”、“<”或“=”)。
(4)在25℃下,KCN溶液pH=9,c(K+)-c(CN_)="_______" mol?L-1(用数字表示但不需近似计算)。
(5)已知Fe(OH)3的溶度积常数Ksp=1.1×10-38。室温时在FeCl3溶液中滴加NaOH溶液,当溶液中Fe3+沉淀完全时,控制pH应不小于 。
(提示:当某离子浓度小于10-5 mol?L-1时可以认为该离子沉淀完全了;)
食盐中的抗结剂是亚铁氰化钾,其化学式为K4[Fe(CN)6] ?3H2O。
42.2g K4[Fe(CN)6] ?3H2O样品受热脱水过程的热重曲线(样品质量随温度的变化曲线)如下图所示。试回答下列问题:

(1)试确定150℃时固体物质的化学式为_______________。
(2)查阅资料知:虽然亚铁氰化钾自身毒性很低,但其水溶液与酸反应放出极毒的氰化氢(HCN)气体;亚铁氰化钾加热至一定温度时能分解产生氰化钾(KCN)。据此判断,烹饪食品时应注意的问题为___________________________________。
(3)在25℃下,将a mol?L-1的KCN(pH>7)溶液与0.01mol?L-1的盐酸等体积混合,反应平衡时,测得溶液pH=7,则KCN溶液的物质的量浓度a_______0.01mol?L-1(填“>”、“<”或“=”)。
(4)在25℃下,KCN溶液pH=9,c(K+)-c(CN_)="_______" mol?L-1(用数字表示但不需近似计算)。
(5)已知Fe(OH)3的溶度积常数Ksp=1.1×10-38。室温时在FeCl3溶液中滴加NaOH溶液,当溶液中Fe3+沉淀完全时,控制pH应不小于 。
(提示:当某离子浓度小于10-5 mol?L-1时可以认为该离子沉淀完全了;)

Ⅰ.在一定体积的密闭容器中,进行如下化学反应:其化学平衡常数K与温度t的关系如下:CO2(g)+H2(g)  CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表:
CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表:
| t(℃) | 700 | 800 | 830 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
 2CO2+N2。为了测定在某种催化剂作用下的反应速率,在某温度下用气体传感器测得不同时间的NO和CO浓度如表:
2CO2+N2。为了测定在某种催化剂作用下的反应速率,在某温度下用气体传感器测得不同时间的NO和CO浓度如表:| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| c(NO) (mol/L) | 1.00×10-3 | 4.50×10-4 | 2.50×10-4 | 1.50×10-4 | 1.00×10-4 | 1.00×10-4 |
| c(CO) (mol/L) | 3.60×10-3 | 3.05×10-3 | 2.85×10-3 | 2.75×10-3 | 2.70×10-3 | 2.70×10-3 |
Ⅰ.在一定体积的密闭容器中,进行如下化学反应:其化学平衡常数K与温度t的关系如下:CO2(g)+H2(g)
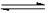 CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表:
CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表:
|
t(℃) |
700 |
800 |
830 |
1000 |
1200 |
|
K |
0.6 |
0.9 |
1.0 |
1.7 |
2.6 |
请回答下列问题:
(1)该反应为 反应(填“吸热”或“放热”)。
(2)800℃,固定容器的密闭容器中,放入混合物,其始浓度为c(CO) =" 0.01" mol/L,c(H2O) =" 0.03" mol/L,c(CO2) =" 0.01" mol/L,c(H2) =" 0.05" mol/L,则反应开始时,H2O的消耗速率比生成速率 __ _(填“大”、“小”或“不能确定”)。
Ⅱ.超音速飞机在平流层飞行时,尾气中的NO会破坏臭氧层。科学家正在研究催化技术将尾气中的NO和CO转变成CO2和N2,其反应为:2NO+2CO 2CO2+N2。为了测定在某种催化剂作用下的反应速率,在某温度下用气体传感器测得不同时间的NO和CO浓度如表:
2CO2+N2。为了测定在某种催化剂作用下的反应速率,在某温度下用气体传感器测得不同时间的NO和CO浓度如表:
|
时间(s) |
0 |
1 |
2 |
3 |
4 |
5 |
|
c(NO) (mol/L) |
1.00×10-3 |
4.50×10-4 |
2.50×10-4 |
1.50×10-4 |
1.00×10-4 |
1.00×10-4 |
|
c(CO) (mol/L) |
3.60×10-3 |
3.05×10-3 |
2.85×10-3 |
2.75×10-3 |
2.70×10-3 |
2.70×10-3 |
请回答下列问题(均不考虑温度变化对催化剂催化效率的影响):
(1)在上述条件下反应能够自发进行,则反应的△H 0(填写“>”、“<”、“=”)。
(2)前2s内的平均反应速率v(N2)= 。
(3)在该温度下,反应的平衡常数K= 。
(4)假设在密闭容器中发生上述反应,达到平衡时下列措施能提高NO转化率的是 。
A.选用更有效的催化剂 B.升高反应体系的温度
C.降低反应体系的温度 D.缩小容器的体积
(5)若在恒温、恒压条件下向平衡体系中通入氩气,则平衡 移动(填“向左”“向右”或“不”);使用催化剂,上述反应的△H________(填“增大” “减小” 或“不改变”)。
选择题答案表:
题号
1
2
3
4
5
6
7
8
答案
A
C
A
C
C
A
D
D
题号
9
10
11
12
13
14
答案
B
AD
C
D
BD
AD
15、(12分)Ⅰ(4分)①②④⑥
Ⅱ(8分)⑴用冰水冷却有利于析出更多的晶体,黑暗可以防止晶体分解(2分)
⑵过滤、洗涤(1分)
⑶100mL容量瓶、酸式滴定管(2分) (紫)红(1分) ⑷3 (2分)
 16、(8分(1)NaClO(1分)(2)
16、(8分(1)NaClO(1分)(2) (1分)
(1分)
(3)2NaCl +2H2O
 H2↑+ Cl2↑+2NaOH (2分) 氯碱工业(1分)
H2↑+ Cl2↑+2NaOH (2分) 氯碱工业(1分)
(4)2Fe3+ + 3ClO? + 10OH? = 2FeO42? + 3Cl? + 5H2O(2分)
②本身被还原成Fe3+而发生水解生成Fe(OH)3胶体吸附水中杂质以达到净化水的目的。(1分)
17、(10分)(1)FeSO4?7H2O (写FeSO4晶体也给分)
(2)防止Fe2+氧化; 取副产品甲少许溶于水,滴加适量KSCN溶液,观察溶液是否变为血红色。
(3)稀盐酸(或稀硫酸等) (4)TiO2  Ti+O2↑
(每空2分,共10分)
Ti+O2↑
(每空2分,共10分)
18、(10分)⑴2NO3-+5Mg+6H2O==N2↑+5Mg(OH)2+2OH-(2分)
⑵①快速方便易行(2分,相近合理答案也给分)
②空白对照实验(2分,相近合理答案也给分)
③将水样先稀释一定倍数后再重复实验(2分)
⑶ 800 (2分)
19、(12分)(1)加成 (1分)(2)13(2分)
(3)(4分) (4)(5分)
(4)(5分)

20、(10分)⑴ 0.01 mol?L-1(2分) 不变(1分)
⑵ <(2分)
⑶ 设焙烧炉中消耗空气的物质的量为5x,鼓风炉中消耗空气物质的量为5y,则:
 Zn(g)+CO2(g)
Zn(g)+CO2(g)
y 2y 1mol 2y×62.5% 1mol
2y×62.5%=1mol y=0.8mol 5y=4mol(2分)
2ZnS + 3O2 = 2ZnO + 2SO2 △n
2mol 1mol
1mol 0.5mol
4x/(5x-0.5mol)=82.5% x=3.3mol 5x=16.5mol(2分)
5x+5y=4mol+16.5mol=20.5mol
V(空气)=20.5×
 21、(12分)
21、(12分)
(1)CD(2分) (2) H3AsO4(1分);第四周期元素,原子核外只有四个电子层。按能量最低原理,4s上排2个电子,3d上排10个电子,4p上排6个电子,共对应18种元素,若4d排电子,就出现了第五电子层,就不是第四周期元素了,所以第四周期只有18种元素。(2分) (2)+3(1分);正四面体(1分);3d74s2(1分) (3)BC(2分)
(4)N2O或CO2或CS2或BeCl2;SCN-或OCN-(2分)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com