
题目列表(包括答案和解析)
在 溶液中,下列等量关系成立的是( )
溶液中,下列等量关系成立的是( )
| A.c(OH-)= c(H+)+c(HCO3-)+2c(H2CO3) |
| B.2c(Na+)= c(CO32-)+ c(HCO3-)+ c(H2CO3) |
| C.c(Na+)+ c(H+)= c(HCO3-) +2c(CO32-)+ c(OH-) |
| D.c(Na+)="2" c(CO32-)+ c(HCO3-)+ c(H2CO3) |
在 溶液中,下列等量关系成立的是( )
溶液中,下列等量关系成立的是( )
A.c(OH-)= c(H+)+c(HCO3-)+2c(H2CO3)
B.2c(Na+)= c(CO32-)+ c(HCO3-)+ c(H2CO3)
C.c(Na+)+ c(H+)= c(HCO3-) +2c(CO32-)+ c(OH-)
D.c(Na+)="2" c(CO32-)+ c(HCO3-)+ c(H2CO3)
 溶液中,下列等量关系成立的是( )
溶液中,下列等量关系成立的是( )| A.c(OH-)= c(H+)+c(HCO3-)+2c(H2CO3) |
| B.2c(Na+)= c(CO32-)+ c(HCO3-)+ c(H2CO3) |
| C.c(Na+)+ c(H+)= c(HCO3-) +2c(CO32-)+ c(OH-) |
| D.c(Na+)="2" c(CO32-)+ c(HCO3-)+ c(H2CO3) |
(16分)下表为长式周期表的一部分,其中的编号代表对应的元素。
| ① |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
| ② |
|
|
|
|
|
|
|
|
|
|
| ③ | ④ | ⑤ | ⑥ |
|
|
| ⑦ |
|
|
|
|
|
|
|
|
|
|
|
|
| ⑧ |
|
|
|
|
|
|
|
| ⑨ |
|
|
|
| ⑩ |
|
|
|
|
|
|
|
(1)写出上表中元素⑨原子的外围电子排布式 。
(2)在元素③与①形成的水果催熟剂气体化合物中,元素③的杂化方式为:
(3)按要求完成下列各题
a.第一电离能:元素④ 元素⑤(选填“>”、“=”、“<”)。
b.与元素④所形成的单质互为等电子体的分子、离子的化学式 、 (各写一种)。
c.元素④的气态氢化物X的水溶液在微电子工业中,可作刻蚀剂H2O2的清除剂,所发生反应的产物不污染环境,其化学方程式为________________________________
d.由X与氧气、KOH溶液构成原电池,负极会产生元素④的单质。则其负极反应式为_____________________________。
(4)由元素③和⑧形成的液态化合物Z,是非极性的直线形分子。0.2mol的Z在O2中完全燃烧,生成两种气态氧化物,298K时放出热量215kJ。该反应的热化学方程式为_________________________
(5)在测定①与⑥形成化合物的相对分子质量时,实验测得的值一般高于理论值的主要原因是: 。
(6)元素⑩所形成的单质晶体中原子的堆积方式如下图甲所示,其晶胞特征如下图乙所示,原子之间相互位置关系的平面图如下图丙所示。 已知该原子的半径为d pm,相对原子质量为M,NA代表阿伏加德罗常数,请回答:
晶体中该原子的配位数为 ,一个晶胞中包含的原子数目为 ;该晶体的密度为 g·cm-3(用字母表示,不必化简)。
【解析】考查元素周期表的结构和元素周期律的应用。根据元素在周期表中的物质可判断,①是H,②是Be,③是C,④是N,⑤是O,⑥是F,⑦是Mg,⑧S,⑨是Cr,⑩是Cu。
(1)因为全充满或半充满是稳定的,所以根据构造原理可知Cr的外围电子排布式3d54s1。
(2)③与①形成的水果催熟剂是乙烯,乙烯中含有碳碳双键,采用的是sp2杂化。
非金属性越强,第一电离能越大,所以N<O。氮气中含有14个电子,所以和氮气互为等电子体的分子是CO,离子是C22-。N的氢化物是氨气,N的化合价处于最低价态,被双氧水氧化生成氮气。原电池中负极失去电子,所以氨气在负极的电极反应式为2NH3-6e-+6OH-===N2+6H2O。
(4)S和C形成的非极性的直线形分子是CS2,所以反应的热化学方程式为CS2(l)+3O2(g)===CO2(g)+2SO2(g) ΔH=-1075 kJ/mol
(5)F是最活泼的非金属元素,H和F形成的氢化物中含有氢键,从而导致测得的值一般高于理论值。
(6)铜形成的是面心立方最密堆积,其配位数是12,根据乙中的结构特点可知一个晶胞中包含的原子数目为![]()
![]() 8×1/8+6×1/2=4。根据丙图可知该晶胞的边长为
8×1/8+6×1/2=4。根据丙图可知该晶胞的边长为 ,所以其密度为
,所以其密度为
(16分)下表为长式周期表的一部分,其中的编号代表对应的元素。
|
① |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
② |
|
|
|
|
|
|
|
|
|
|
|
③ |
④ |
⑤ |
⑥ |
|
|
|
⑦ |
|
|
|
|
|
|
|
|
|
|
|
|
|
⑧ |
|
|
|
|
|
|
|
|
⑨ |
|
|
|
|
⑩ |
|
|
|
|
|
|
|
(1)写出上表中元素⑨原子的外围电子排布式 。
(2)在元素③与①形成的水果催熟剂气体化合物中,元素③的杂化方式为:
(3)按要求完成下列各题
a.第一电离能:元素④ 元素⑤(选填“>”、“=”、“<”)。
b.与元素④所形成的单质互为等电子体的分子、离子的化学式 、 (各写一种)。
c.元素④的气态氢化物X的水溶液在微电子工业中,可作刻蚀剂H2O2的清除剂,所发生反应的产物不污染环境,其化学方程式为________________________________
d.由X与氧气、KOH溶液构成原电池,负极会产生元素④的单质。则其负极反应式为_____________________________。
(4)由元素③和⑧形成的液态化合物Z,是非极性的直线形分子。0.2mol的Z在O2中完全燃烧,生成两种气态氧化物,298K时放出热量215kJ。该反应的热化学方程式为_________________________
(5)在测定①与⑥形成化合物的相对分子质量时,实验测得的值一般高于理论值的主要原因是: 。
(6)元素⑩所形成的单质晶体中原子的堆积方式如下图甲所示,其晶胞特征如下图乙所示,原子之间相互位置关系的平面图如下图丙所示。 已知该原子的半径为d pm,相对原子质量为M,NA代表阿伏加德罗常数,请回答:
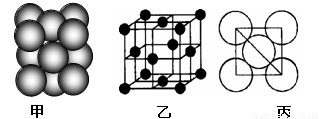
晶体中该原子的配位数为 ,一个晶胞中包含的原子数目为 ;该晶体的密度为 g·cm-3(用字母表示,不必化简)。
【解析】考查元素周期表的结构和元素周期律的应用。根据元素在周期表中的物质可判断,①是H,②是Be,③是C,④是N,⑤是O,⑥是F,⑦是Mg,⑧S,⑨是Cr,⑩是Cu。
(1)因为全充满或半充满是稳定的,所以根据构造原理可知Cr的外围电子排布式3d54s1。
(2)③与①形成的水果催熟剂是乙烯,乙烯中含有碳碳双键,采用的是sp2杂化。
非金属性越强,第一电离能越大,所以N<O。氮气中含有14个电子,所以和氮气互为等电子体的分子是CO,离子是C22-。N的氢化物是氨气,N的化合价处于最低价态,被双氧水氧化生成氮气。原电池中负极失去电子,所以氨气在负极的电极反应式为2NH3-6e-+6OH-===N2+6H2O。
(4)S和C形成的非极性的直线形分子是CS2,所以反应的热化学方程式为CS2(l)+3O2(g)===CO2(g)+2SO2(g) ΔH=-1075 kJ/mol
(5)F是最活泼的非金属元素,H和F形成的氢化物中含有氢键,从而导致测得的值一般高于理论值。
(6)铜形成的是面心立方最密堆积,其配位数是12,根据乙中的结构特点可知一个晶胞中包含的原子数目为
 8×1/8+6×1/2=4。根据丙图可知该晶胞的边长为
8×1/8+6×1/2=4。根据丙图可知该晶胞的边长为 ,所以其密度为
,所以其密度为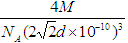
1.D 2.C 3.C 4.B 5.C 6.C 7.BC 8.BD 9.AC 10.D 11.C
12.BD 13.AC 14.A 15.B 16.D 17.B 18.D 19.B 20.D
21.D 22.C w.w.w.k.s.5.u.c.o.m
23.(1)促进,A (2)甲大
乙用氯化铵溶液稀释后,[ ]增大很多,使
]增大很多,使 的电离平衡向抑制电离的方向移动;
的电离平衡向抑制电离的方向移动; 发生水解,使稀释后的乙溶液的[
发生水解,使稀释后的乙溶液的[ ]增大
]增大
24.(1)第一种组合 A:NaOH B:
第二种组合 A: B:
B:
(2)由于 电离出
电离出 ,使水的电离平衡:
,使水的电离平衡:

 向左移动,使水的电离度小于纯水中水的电离度,而
向左移动,使水的电离度小于纯水中水的电离度,而 溶液中由于
溶液中由于


由于 电离出的
电离出的 与
与 结合生成弱电解质
结合生成弱电解质 ,从而促进水的电离,使水的电离度比纯水中的大.
,从而促进水的电离,使水的电离度比纯水中的大.
25.(1)偏高;空气中的氧气溶于样品中
(2)偏高;使 溶液浓度变低,消耗体积偏大
溶液浓度变低,消耗体积偏大
(3)偏高;使最后读取体积数比实际消耗 溶液体积数大
溶液体积数大
(4)
26.(1)增大w.w.w.k.s.5.u.c.o.m
(2)K值越大,酸性越强
(3)

(4) 上一级电离产生的
上一级电离产生的 对下一级电离有抑制作用
对下一级电离有抑制作用
(5)
27.(1) 和
和 水解均呈弱酸性,可除去金属表面的氧化物
水解均呈弱酸性,可除去金属表面的氧化物
(2) 水溶液中[
水溶液中[ ]很小,不会生成沉淀(或弱酸不能生成强酸).加入氨水时,
]很小,不会生成沉淀(或弱酸不能生成强酸).加入氨水时,

 ,使
,使 电离平衡右移,[
电离平衡右移,[ ]增大,产生沉淀(或
]增大,产生沉淀(或 与
与 生成
生成 ,使[
,使[ ]增大
]增大
(3)在HCl气流中, 抑制
抑制 水解,从而可得到
水解,从而可得到 无水物
无水物
(4)能. ,降低[
,降低[ ],其水解平衡左移,碱性减弱
],其水解平衡左移,碱性减弱
(5) 水解呈碱性,
水解呈碱性, 水解呈酸性,二者混合施用,会促进水解,大量生成易挥发的
水解呈酸性,二者混合施用,会促进水解,大量生成易挥发的 ,从而使氮肥降低肥效
,从而使氮肥降低肥效
 电离呈酸性,与
电离呈酸性,与 混合施用,会产生
混合施用,会产生 或
或 沉淀而丧失肥效.
沉淀而丧失肥效.
硫铵(即硫酸铵)水解呈酸性,长期施用土壤会板结酸化,加消石灰可调节酸度,防止板结.
28.(1)造成测定数值偏高w.w.w.k.s.5.u.c.o.m
(2)
(3)
29.(1) ;
; 、
、
(2)1.90 2.67 5.20
(3)130
分析:(1)因为在浊液中加入HCl溶液至10 mL,沉淀质量一直为 形式存在,继续加入HCl溶液,
形式存在,继续加入HCl溶液, 转变为
转变为 沉淀,加至30 mL时,
沉淀,加至30 mL时, 全部转变为
全部转变为 ,所以在A点的沉淀物为
,所以在A点的沉淀物为 ,在A至B点间,沉淀物为
,在A至B点间,沉淀物为 和
和 的混合物.当加入的HCl溶液超过30 mL时,
的混合物.当加入的HCl溶液超过30 mL时, 和
和 同时溶解.w.w.w.k.s.5.u.c.o.m
同时溶解.w.w.w.k.s.5.u.c.o.m
(2)原混合物中:
 的质量
的质量


 的质量
的质量
NaOH:
①浊液中存在的:
1×0.01 mol
② 消耗的:
消耗的:


③ 消耗的:
消耗的:

0.02 mol×4=0.08 mol
NaOH总质量
(3)从B点开始, 消耗的HCl:0.02 mol×3=0.06 mol
消耗的HCl:0.02 mol×3=0.06 mol
 消耗的HCl:0.02 mol×2=0.04 mol
消耗的HCl:0.02 mol×2=0.04 mol
所消耗HCl溶液的体积为:
Q点HCl溶液总量为:30 mL+100 mL=130 mL
30.(1)
(2)

根据 
过量 为:
为:
20.00 mL水样消耗 为
为
根据得电子数目相等,则有
相当于 为:
为:
 ,即该水样的
,即该水样的
(3)
(4)A,
 www.ks5u.com
www.ks5u.com
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com