
题目列表(包括答案和解析)
| 容器编号 | n(O2) | n(NO) | n (NO2) | v正与v逆的关系 |
| Ⅰ | 0.20 | 0.10 | 0.20 | v正=v逆 |
| Ⅱ | 0.20 | 0.40 | 1.00 | ②v正____v逆 |
| Ⅲ | 0.60 | 1.20 | 0.80 | ③v正____v逆 |

 请回答下列问题:
请回答下列问题: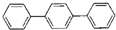 它的分子式为
它的分子式为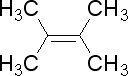

一、单项选择题(本题包括8小题,每题3分,共24分。)
1.D 2.B 3.A 4.D 5.B 6.C 7.C 8.A
二、不定项选择题(本题包括6小题,每小题4分,共24分。)
9.AD 10.B 11.BC 12.AD 13.CD 14.C
三、非选择题(本题包括6小题,共60分)
15.(10分)
【提出猜想】 SO2、H2
【实验探究】
猜想Ⅰ
步骤① 溶液紫红色褪去 含有Fe2+
步骤② 另取少量所得溶液,滴加KI和淀粉溶液 溶液变为蓝色
猜想Ⅱ
甲中KMnO4溶液褪色,乙中KMnO4溶液颜色不变,试管中收集到气体
【问题讨论】
不正确。若溶液中含有Fe3+则无法检验溶液中是否含有Fe2+
16.(8分)
 ⑴ HNO3
⑴ HNO3
⑵ 3CuO+2NH3 3Cu+N2+3H2O
⑶ 2Cu2++2Cl-+SO2+2H2O=2CuCl↓+4H++SO42-

⑷ 6NO+4NH3 5N2+6H2O
17.(10分)
(1)0.3 mol/(L?min) 升高温度
(2)

(3)-41.2 kJ/mol a
18.(10分)
⑴ 熵变大于零(△S>0) 隔绝空气
⑵ 10 TiO2++2H2O=TiO(OH)2↓+2H+
⑶ d
19.(12分)
(1)4
(2) 还原反应
还原反应
(3) 、
、
(4)
20.(10分)

⑴ ①
② 解:(C6H10O5)n~n C6H12O6~2nC2H5OH~nCH3COOC2H5
162n 88n
m(CH3COOC2H5)=374 kg
⑵ 解:[(C6H7O2)(OH)3]n~[(C6H7O2)(OH)(3-x)(OOCCH3)x]n △m
162n 162n+42nx 42nx
 =
= x=2
x=2
故该醋酸纤维的结构简式为[(C6H7O2)(OH)(OOCCH3)2]n
四、选做题(本题包括1小题,共12分)
21.(12分)
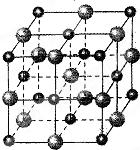
A.⑴ O>N>C 1s22s22p63s23p63d84s2
⑵ 顺铂易溶于水,因为它是极性分子,易溶于极性溶剂
⑶ 4
⑷
① ② sp3和sp2
② sp3和sp2
B.⑴ 玻璃棒、胶头滴管 煮沸除去CO2并迅速冷却
⑵ 酚酞 滴定产物CH3COONa溶液呈碱性,应选择在碱性范围中变色的指示剂
⑶ 用活性炭脱色
⑷ 4.50
2009年南通市高三年级第一次调研测试
化学试题分析
1.【行为目标】本题以环境保护为背景,提醒考生关注时事、关注社会。
【内容领域】化学基本概念和基本理论
【解题提示】氟利昂虽然性质稳定,但能破坏臭氧层。
【答 案】D
【难度系数】0.85(了解,较容易)
2.【行为目标】很多情况下,相同的反应物在浓度、温度、用量、溶剂等外界条件不同时,得到的产物不同。本题以这一基本化学事实为命题背景,考查学生对元素化合物知识和有机化学知识的掌握情况。
【内容领域】元素及其化合物
【解题提示】氯化铝溶液与氨水反应生成Al(OH)3,但Al(OH)3不溶于过量氨水。
【答 案】D
【难度系数】0.75(理解,较容易)
3.【行为目标】相同的化学实验现象,发生的变化不一定相同,涉及的反应原理也不一定相同。本题以这一基本辩证观念为命题素材,考查学生对元素化合物知识和有机化学知识的掌握情况。
【内容领域】元素及其化合物
【解题提示】蛋白质溶液中加入硫酸铵溶液有沉淀析出,发生了盐析,是物理变化,而加入硫酸铜溶液有沉淀析出,发生了变性,是化学变化;氯化钡溶液中通入二氧化硫气体后,加氯水将二氧化硫氧化为硫酸根后产生硫酸钡沉淀,加入氨水将二氧化硫转化为亚硫酸根,发生复分解反应生成亚硫酸钡沉淀;烧碱和纯碱的溶液在无色火焰上灼烧,都是发生焰色反应;二氧化硅溶于氢氧化钠溶液是酸性氧化物与碱的反应,而二氧化硅溶于氢氟酸的反应原理不同。
【答 案】C
【难度系数】0.75(理解,较容易)
4.【行为目标】从海带中提取碘是海洋资源综合利用的一种方法。本题以从海带中提取碘的过程为命题背景,考查的物质分离与提纯的有关实验操作。
【内容领域】化学实验
【解题提示】海带灼烧成灰应在坩埚中进行;过滤时应用玻璃棒引流;碘的苯溶液在分液漏斗中位于上层,应待下层液体放出后从上口倒出;分离碘并回收苯应用蒸馏的方法,用水浴加热能控制温度不至于太高而防止碘的升华。
【答 案】D
【难度系数】0.55(理解,中等难度)
5.【行为目标】DDT在生物体内难以降解,为此科学家研制了很多替代产品,本题其中一种替代品为素材,考查有机物的结构、官能团和化学性质。
【内容领域】有机化学基础
【解题提示】化合物A中含有的官能团有碳碳双键、醛基和醇羟基,没有苯环结构,所以它能发生加成反应、取代反应和银镜反应,不能与氯化铁溶液反应显紫色,分子中至少有5个碳原子共平面,与氢气完全加成时的物质的量之比为1∶3。
【答 案】B
【难度系数】0.75(理解,较容易);
6.【行为目标】该题以阿伏加德罗常数的应用为载体,考查学生对原电池、盐类的水解、可逆反应等基本理论知识的掌握应用和相关的计算能力,考查学生思维的缜密性和思维的灵活性。
【内容领域】化学计算
【解题提示】NH4Cl溶液中由于NH4+的水解而使NH4+离子数目减少;常温下Cu-Zn原电池中产生的
【答 案】C
【难度系数】0.65(理解,中等难度)
7.【行为目标】该题以“周期表中元素的推断”为载体,考查学生对元素周期表的熟悉程度及其对表中各元素性质和相应原子结构的周期性递变规律的认识和掌握程度。
【内容领域】化学基本概念和基本理论
【解题提示】题中的X、Y、Z、W对应的元素有3种可能:C、N、Al、Si;N、O、Si、P;O、F、P、S。
【答 案】C
【难度系数】0.55(理解,中等难度);
8.【行为目标】本题以几种不同酸碱性溶液中的离子共存问题为载体,考查常见离子的性质及溶液的pH、水的电离等基本理论知识。
【内容领域】元素及其化合物
【解题提示】题中4个选项的设置是经过深思熟虑的:A是酸性溶液,B是碱性溶液,C、D既可能是酸性溶液也可能是碱性溶液;A一定能大量共存,B、C一定不能大量共存,D可能大量共存。本题不仅是一道考题,也是一道很好的复习题。
【答 案】A
【难度系数】0.65(理解,中等难度)
9.【行为目标】烤蓝是钢铁防腐的一种方法,本题以烤蓝的反应原理为载体考查物质的分类和氧化还原反应的相关概念。
【内容领域】化学基本概念
【解题提示】反应②配平后H2O的化学计量数为5,反应③不是氧化还原反应。
【答 案】AD
【难度系数】0.5(理解,较难)
10.【行为目标】本题考查一些常见离子反应方程式正误的判断。判断离子方程式的正误,一般从4个方面进行:是否符合客观事实、化学式的拆分是否正确、配平是否正确、是否符合反应物间量的关系,命题时往往从中设置错误选项。
【内容领域】元素及其化合物
【解题提示】A中硝酸能将+2价铁和-2价硫氧化,不可能只发生复分解反应;C中HCO3-不应拆开;D中通入过量CO2应生成HCO3-。
【答 案】B
【难度系数】0.6(理解,中等难度)
11.【行为目标】本题以两个定量实验和两个制备实验为载体,考查化学实验的基本操作。
【内容领域】化学实验
【解题提示】浓盐酸极易挥发,不能精确配制一定物质的量浓度的溶液;酸碱中和滴定中,滴定管需用待装液体润洗而锥形瓶不需要;浓氨水中加入生石灰,既使温度升高又增大了OH-浓度,可以得到氨气,通过碱石灰后能得到干燥、纯净的氨气;向氯化铁溶液中加入氢氧化钠溶液,得到的是氢氧化铁沉淀而不是胶体。
【答 案】BC
【难度系数】0.4(理解,较难)
12.【行为目标】本题以电解原理在工业上的应用。
【内容领域】化学基本理论
【解题提示】铜的电解精炼时,应用粗铜作阳极、纯铜作阴极;电镀时,应以镀层金属作阳极、待镀金属作阴极。
【答 案】AD
【难度系数】0.65(理解,中等难度)
13.【行为目标】该题要求要求学生根据溶液中盐的水解、弱电解质的电离、电荷守恒等化学变化的规律,判断溶液中离子浓度的相对大小,综合考查学生对电解质溶液基本原理的理解情况和综合分析解决问题的能力。
【内容领域】化学基本概念和基本理论
【解题提示】A中HCO3-、CO32-的浓度不可能都大于0.1 mol/L,否则加起来就大于0.2 mol/L;B中所得混合溶液应显酸性;C实际考查的是电荷守恒,c(Na+)=0.1
mol/L;D中可得电荷守恒等式c(Na+)+c(H+)= c(HCO3-)+
【答 案】CD
【难度系数】0.45(理解,较难)
14.【行为目标】本题考查关于混合物的简单化学计算。
【内容领域】化学计算
【解题提示】n(SO42-)=b mol,n(NH4+)=c mol,根据电荷守恒,n(Al3+)= mol。
mol。
【答 案】C
【难度系数】0.75(理解,较容易)
15.【行为目标】本题是一条综合性较强的化学实验题,题目以对加热条件下铁与浓硫酸反应所得溶液和气体的成分探究为情景素材,考查学生提出猜想以及对探究方案、探究过程、探究结论等进行分析和评价,能准确地表述探究结果,并应用探究结果解决相关问题的能力。
【内容领域】化学实验
【解题提示】加热条件下铁与浓硫酸反应的化学原理,可以根据铜与浓硫酸反应的原理迁移,其产物有硫酸铁和二氧化硫;同时注意到随着反应的进行,硫酸的浓度变稀,铁与稀硫酸反应生成硫酸亚铁和氢气。猜想Ⅰ实际是Fe3+、Fe2+的检验,因为给出的结论中两种气体均有,所以一定含有Fe2+。猜想Ⅱ是SO2、H2的检验,但要注意试剂、操作和装置对检验方法的限制,例如H2的检验不能采用爆鸣实验。教材中Fe2+的检验采用的试剂是KSCN溶液和氯水,但该方法在有Fe3+的检验存在的条件下不能使用。
【答 案】【提出猜想】 SO2、H2
【实验探究】
猜想Ⅰ
步骤① 溶液紫红色褪去 含有Fe2+
步骤② 另取少量所得溶液,滴加KI和淀粉溶液 溶液变为蓝色
猜想Ⅱ
甲中KMnO4溶液褪色,乙中KMnO4溶液颜色不变,试管中收集到气体
【问题讨论】
不正确。若溶液中含有Fe3+则无法检验溶液中是否含有Fe2+
【难度系数】0.55(综合应用,中等难度)
16.【行为目标】本题以无机框图题的形式考查N、S、Cu等元素单质及其化合物之间的相互转化关系和逻辑推理能力、化学用语的书写能力,同时进一步训练学生依据质量守恒定律、氧化还原反应方程式的配平方法书写陌生化学方程式的技能,最后一空引导学生关注人与自然的和谐发展。
【内容领域】元素及其化合物
【解题提示】本题中E为红色金属,非金属气体单质A、B放电生成F等均为解题突破口,推出A、D即可推出G、H。本题中H到K的变化是本题的难点,J到K是学生未知知识,需要结合第⑶问题提示以及氧化还原反应知识进行推理,对学生的逻辑推理能力提出较高要求。
【答 案】⑴
HNO3 ⑵ 3CuO+2NH3 3Cu+N2+3H2O
3Cu+N2+3H2O
⑶ 2Cu2++2Cl-+SO2+2H2O=2CuCl↓+4H++SO42- ⑷ 6NO+4NH3 5N2+6H2O
5N2+6H2O
【难度系数】0.6(理解应用,中等难度)
17.【行为目标】本题以从甲烷得到合成气的3个反应为载体,考查学生对化学反应速率、化学平衡常数、化学平衡的移动、盖斯定律计算反应热等基本理论知识的掌握情况,以及应用相关知识解决实际问题的能力,具有一定的综合性。
【内容领域】化学基本概念和基本理论
 【解题提示】⑴应根据图像先计算CH4的平均反应速率,再计算H2的生成速率。10 min时,改变的条件不可能是增大容器体积,否则改变条件的瞬间CH4浓度应减小。改变的条件可能是升高温度(或充入水蒸气)。
【解题提示】⑴应根据图像先计算CH4的平均反应速率,再计算H2的生成速率。10 min时,改变的条件不可能是增大容器体积,否则改变条件的瞬间CH4浓度应减小。改变的条件可能是升高温度(或充入水蒸气)。
(2)甲容器反应开始后压强增大,乙容器压强不变、体积增大,可看成是由甲容器减压得到,乙容器的反应速率慢、CH4转化率大。
(3)将反应①减去反应②即可得到反应③的反应热,根据浓度商小于平衡常数可以判断反应向正反应方向进行。v(正)>v(逆)
【答 案】(1)0.3 mol/(L?min) 升高温度(或充入水蒸气) (2)如图 (3)-41.2 kJ/mol a
【难度系数】0.65(综合应用,中等难度)
18.【行为目标】本题通过钛及其化合物的制备与应用为背景素材,考查学生运用化学理论知识解决工业实际问题的能力以及对图表、图示的观察、分析、运用和数据处理能力。
【内容领域】化学基本理论
【解题提示】⑴化学反应的发生至少必须满足“焓变小于零、熵变大于零”中的一个;反应控制在隔绝空气(或在惰性环境中进行)的条件下进行,是考虑到金属镁与空气中氧气、氮气、二氧化碳的反应(钛的性质、四氯化钛的水解等知识学生不熟悉)。⑵第一问主要考查Ksp与pH的简单计算,第二问由于TiO(OH)2的Ksp最小,故最容易水解。⑶依据M[BaTiO (C2O4)2?4H2O]:M(BaTiO3)=10.00:5.19,可知白色固体A的化学式为BaTiO (C2O4)2?4H2O。
【答 案】⑴ 该反应熵变大于零(△S>0) 隔绝空气(或在惰性环境中进行)
⑵ 10 TiO2++2H2O=TiO(OH)2↓+2H+
⑶ d
【难度系数】0.6(综合应用,中等难度)
19.【行为目标】本题以局部麻醉剂氯普鲁卡因盐酸盐的合成为背景,考查核磁共振氢谱测定有机物的结构、有机反应的类型、反应产物的判断、同分异构体以及合成路线的设计。本题是一道有机化合物的推断与合成题,设计巧妙,将有机合成与信息迁移融合在一起,既考查学生利用题设信息,运用逆合成分析法解决与有机合成相关的实际问题的能力,也考查学生设计有机合成方案的能力,在较高层次上考查了学生对信息接受和处理的敏锐程度和思维的整体性,全面考查了学生的综合能力。
【内容领域】有机化学基础
【解题提示】不同的物质不可能有相同的核磁共振氢谱,甲苯分子中有4中不同化学环境的氢原子,只有核磁共振氢谱出现4个峰时才能说明甲苯是纯净的。反应①是酯交换反应,考试说明虽未作为考点,题中也未给出相关信息,但由合成路线“逆推”可知,反应③显然是与盐酸成盐,反应②显然是将硝基还原为氨基,不难推出B的结构。同分异构体的书写可采用“插入法”,即向 的C-C键或C-H键中插入酯基。设计合成路线时,应根据题设信息,充分考虑苯环上的定位规则,设计最佳合成线路。
的C-C键或C-H键中插入酯基。设计合成路线时,应根据题设信息,充分考虑苯环上的定位规则,设计最佳合成线路。
【答 案】(1)4 (2) 还原反应
还原反应
(3) 、
、
(4)
【难度系数】0.65(理解应用,中等难度)
20.【行为目标】本题以淀粉、纤维素等可再生资源的综合利用为背景,考查学生利用关系式法进行化学方程式、化学式计算的技能,同时考查学生摄取信息的能力。
【内容领域】有机物的结构、有机反应、化学计算
【解题提示】葡萄糖在水溶液中的环状结构是由于羟醛缩合导致,由此,依据六元环结构式可写出五元环结构式。根据淀粉转化为乙酸乙酯的流程图可知,生产中的乙醇一部分用于氧化生成乙酸,一部分用于和乙酸反应制取乙酸乙酯,结合相关化学方程式,列出各物质之间的定量关系求解乙酸乙酯的质量。纤维素中一个葡萄糖单元含有3个羟基,与乙酸、乙酸酐[(CH3CO)2O]的混合物酯化时,3个甲基是不是全部参加反应?有了这个意识,第⑵就不难求解。
【答 案】 ⑴ ①
② 解:(C6H10O5)n~n C6H12O6~2nC2H5OH~nCH3COOC2H5
162n 88n
m(CH3COOC2H5)=374 kg
⑵ 解:[(C6H7O2)(OH)3]n~[(C6H7O2)(OH)(3-x)(OOCCH3)x]n △m
162n 162n+42nx 42nx
 =
= x=2
x=2
故该醋酸纤维的结构简式为[(C6H7O2)(OH)(OOCCH3)2]n
【难度系数】0.45(理解应用,较难)
【内容领域】物质结构与性质
【解题提示】⑴非金属性越强,电负性越大;结合元素的原子序数、元素在周期表中的位置等可以很方便地确定其外围电子排布,进而书写原子核外电子排布式。⑵物质的溶解性多数符合“相似相溶”的规律。⑶金属铂的晶胞中含有铂原子数为8× +6×
+6× =4。 ⑷第二周期中与乙烷互为等电子体的气态氢化物不存在,应该由两个碳原子联想到一个氮原子和一个硼原子组成与乙烷相似的氢化物。其中B原子提供空轨道,N原子提供孤对电子;根据等电子体的结构相似,X、Y中氮原子、硼原子的轨道杂化方式与乙烯、乙炔中的碳原子均相同。说明:Y的结构简式为H2B=NH2。
=4。 ⑷第二周期中与乙烷互为等电子体的气态氢化物不存在,应该由两个碳原子联想到一个氮原子和一个硼原子组成与乙烷相似的氢化物。其中B原子提供空轨道,N原子提供孤对电子;根据等电子体的结构相似,X、Y中氮原子、硼原子的轨道杂化方式与乙烯、乙炔中的碳原子均相同。说明:Y的结构简式为H2B=NH2。
【答 案】⑴O>N>C 1s22s22p63s23p63d84s2 ⑵顺铂易溶于水,因为它是极性分子,易溶于极性溶剂 ⑶4 ⑷① ②sp3和sp2
②sp3和sp2
【难度系数】0.7(初步理解,较容易)
21 B.【行为目标】本题考查学生运用中和滴定法测定食醋中总酸量的实验以及样品处理、数据处理、指示计选用、实验方案改进、误差分析等实验技能和定量分析的化学思想。难度不大,但具有《实验化学》模块的特点。
【内容领域】实验化学
【解题提示】蒸馏水中溶有的CO2能消耗NaOH,不出去将会使试验结果偏大;滴定产物NaAc溶液呈碱性,应选择在碱性溶液中变色的指示剂;第4次记录的数据异常,计算时应舍去。
【答 案】⑴ 煮沸除去CO2并迅速冷却 玻璃棒、胶头滴管 ⑵ 酚酞 滴定产物CH3COONa溶液水解呈碱性,应选择在碱性溶液中变色的指示剂 ⑶ 用活性炭脱色(或滴定过程中使用pH计测定pH) ⑷ 4.50
【难度系数】0.7(初步理解,较容易) www.ks5u.com
www.ks5u.com
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com