
题目列表(包括答案和解析)
实验室完成下列实验时,不需要考虑尾气吸收装置的是( )
A.CO+CuO![]() Cu+CO2
Cu+CO2
B.Cu+2H2SO4(浓)![]() CuSO4+SO2↑+2H2O
CuSO4+SO2↑+2H2O
C.MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
D.2KClO3![]() 2KCl+3O2↑
2KCl+3O2↑
2008年9月25日,“神七”成功飞天,宇航员出舱时呼吸所有需氧气主要来自太空服中的呼吸面具。下列反应均能产生氧气,其中最适宜用呼吸面具中提供氧的反应是
A 4HNO3![]() 4HNO2á +O2á+2H2O
4HNO2á +O2á+2H2O
B 2H2O2![]() 2H2O+O2á
2H2O+O2á
C 2Na2O2+2CO2====2Na2CO3+O2
D 2KClO3![]() 2KCl+3O2á
2KCl+3O2á
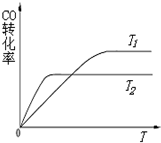 甲醇具有开发和应用广阔的前景.工业上一般采用下列两种途径合成甲醇:
甲醇具有开发和应用广阔的前景.工业上一般采用下列两种途径合成甲醇:| 温度 | 250℃ | 350℃ |
| K | 2.041 | 0.012 |
| c(CH3OH) |
| c(CO)?c2H(2) |
| c(CH3OH) |
| c(CO)?c2H(2) |
 (2013?珠海模拟)甲醇是一种优质燃料,可制作燃料电池.
(2013?珠海模拟)甲醇是一种优质燃料,可制作燃料电池.| 1 |
| 2 |
| 1 |
| 2 |
一、选择题(本题包括6小题,每小题2分,共12分。每小题只有一个选项符合题意)
1.B 2.C 3.B 4.C 5.A 6.C
二、选择题(本题包括10小题,每小题3分,共30分。每小题只有一个选项符合题意)
7.D 8.B 9.D 10.A 11.B 12.D 13.D 14.C 15.C 16.A
三、(本题包括2小题,共18分)
17.③⑤(共2分,每项1分,漏选一项扣1分,错选一项不得分)
18.(16分)
I(1) (2分);形成了原电池,加热蒸发、冷却结晶、过滤并洗涤晶体。
(2分);形成了原电池,加热蒸发、冷却结晶、过滤并洗涤晶体。
(2)丙,戊,乙,甲
Ⅱ(1)吸收 放出等物质的量的
放出等物质的量的
(2)干燥 和
和
(3)②调节量筒使其液面与E装置中的液面持平。
③读曲量筒中液体体积时,视线与液体的凹液面相平。(其他合理答案均可)
(4) (2分,期于每空1分)
(2分,期于每空1分)
四、(本题共12分,每空2分)
19.(12分)(1) (2分)
(2分)
(2)铁丝上附有红色物质,溶液颜色逐渐变为浅绿色。(2分)
(3)①③(2分)(每项1分,漏选一项扣1分,错选一项不得分)
(4) (2分)
(2分)
(5) (或
(或 (2分);1(2分)
(2分);1(2分)
五、(本题包括2小题,共18分)
 20.(10分)(1)
20.(10分)(1) (2分)
(2分)
(2) (2分)
(2分)
(3)a、c(2分,答对1个1分,多选、选错为0分)
(4)向正反应方向(1分);不变(1分)
(5)(2分)如右图:
21.(8分)(1)大于7(2分)
(2)无法确定,(1分) 溶液中同时存在
溶液中同时存在
 因两个平衡程度无法确定,故难以确定溶液酸碱性。(2分)
因两个平衡程度无法确定,故难以确定溶液酸碱性。(2分)
(3)C、D(2分)
选做部分
六、(共2个题,考生从中选择1个题作答)
22.(10分)
(1)I.ⅡA(2分) Ⅱ.ⅣA(2分) b(2分)
(2) (1分) C(1分)
(1分) C(1分)
(3) (2分)
(2分)
23.(10分,每空2分)
(1) (2分)
(2分)

湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com