
题目列表(包括答案和解析)
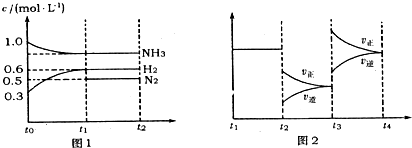
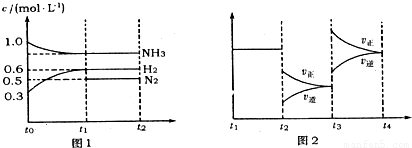
| 10-8 |
| a-0.1 |
| 10-8 |
| a-0.1 |
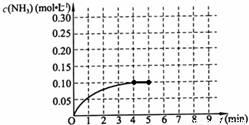
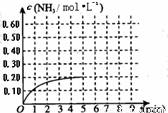
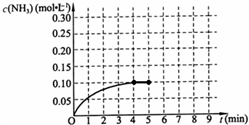 在一容积为2L的密闭容器中,加入0.2mol的N2和0.6mol的H2,在一定条件下发生如下反应:N2(g)+3H2(g)?2NH3(g)△H<0;反应中NH3的物质的量浓度的变化情况如图所示,请回答下列问题:
在一容积为2L的密闭容器中,加入0.2mol的N2和0.6mol的H2,在一定条件下发生如下反应:N2(g)+3H2(g)?2NH3(g)△H<0;反应中NH3的物质的量浓度的变化情况如图所示,请回答下列问题:一、选择题(本题包括6小题,每小题2分,共12分。每小题只有一个选项符合题意)
1.B 2.C 3.B 4.C 5.A 6.C
二、选择题(本题包括10小题,每小题3分,共30分。每小题只有一个选项符合题意)
7.D 8.B 9.D 10.A 11.B 12.D 13.D 14.C 15.C 16.A
三、(本题包括2小题,共18分)
17.③⑤(共2分,每项1分,漏选一项扣1分,错选一项不得分)
18.(16分)
I(1) (2分);形成了原电池,加热蒸发、冷却结晶、过滤并洗涤晶体。
(2分);形成了原电池,加热蒸发、冷却结晶、过滤并洗涤晶体。
(2)丙,戊,乙,甲
Ⅱ(1)吸收 放出等物质的量的
放出等物质的量的
(2)干燥 和
和
(3)②调节量筒使其液面与E装置中的液面持平。
③读曲量筒中液体体积时,视线与液体的凹液面相平。(其他合理答案均可)
(4) (2分,期于每空1分)
(2分,期于每空1分)
四、(本题共12分,每空2分)
19.(12分)(1) (2分)
(2分)
(2)铁丝上附有红色物质,溶液颜色逐渐变为浅绿色。(2分)
(3)①③(2分)(每项1分,漏选一项扣1分,错选一项不得分)
(4) (2分)
(2分)
(5) (或
(或 (2分);1(2分)
(2分);1(2分)
五、(本题包括2小题,共18分)
 20.(10分)(1)
20.(10分)(1) (2分)
(2分)
(2) (2分)
(2分)
(3)a、c(2分,答对1个1分,多选、选错为0分)
(4)向正反应方向(1分);不变(1分)
(5)(2分)如右图:
21.(8分)(1)大于7(2分)
(2)无法确定,(1分) 溶液中同时存在
溶液中同时存在
 因两个平衡程度无法确定,故难以确定溶液酸碱性。(2分)
因两个平衡程度无法确定,故难以确定溶液酸碱性。(2分)
(3)C、D(2分)
选做部分
六、(共2个题,考生从中选择1个题作答)
22.(10分)
(1)I.ⅡA(2分) Ⅱ.ⅣA(2分) b(2分)
(2) (1分) C(1分)
(1分) C(1分)
(3) (2分)
(2分)
23.(10分,每空2分)
(1) (2分)
(2分)

湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com