
题目列表(包括答案和解析)
(9分)某化学兴趣小组为了测定铁碳合金中铁的质量分数,并探究浓硫酸的某些性质,设计了下图所示的实验装置和实验方案,请并回答相应问题。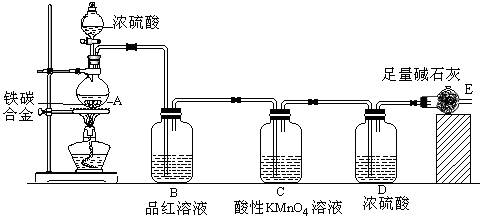
Ⅰ.探究浓硫酸的某些性质:
(1)按图示的连接装置,检查装置的气密性,称量E的质量。
(2)将ag铁碳合金样品放入A中,再加入适量的浓硫酸,未点燃酒精灯前,A、B基本上均无明显现象,其原因是____ _______________;加热A一段时间后,A、B中可观察到明显的现象,其中B中的现象为_______________,任写出一个A中发生反应的化学方程式________________________________________。
(3)反应相当一段时间后,从A中逸出气体的速率仍然较快,除因温度较高,其它可能的原因是 。并且发现此时产生的气体具有可燃性,请用离子方程式表示产生此种气体的原因____________________________________。
Ⅱ.测定铁的质量分数
(4)待A中不再逸出气体时,停止加热,拆下E并称重。E增重bg。则铁碳合金中铁的质量分数为 ![]() (写表达式)(5)最后对所得测量结果进行评价时,小组内有同学提出,本套装置在设计上存在多处缺陷而导致实验结果不准确,其中会导致铁质量分数测量值偏低是(任答一条可) 。
(写表达式)(5)最后对所得测量结果进行评价时,小组内有同学提出,本套装置在设计上存在多处缺陷而导致实验结果不准确,其中会导致铁质量分数测量值偏低是(任答一条可) 。
某化学兴趣小组为了测定某铁碳合金中铁的质量分数,并探究浓硫酸的某些性质,设计了下图所示的实验装置和实验方案(夹持仪器已省略),请据此项回答相应问题。
Ⅰ 探究浓硫酸的某些性质
(1)按图示连接装置,检查装置的气密性,称量E的质量。
(2)将a g铁碳合金样品放入A中,再加入适量的浓硫酸。仪器A的名称为____________,
未点燃酒精灯前,A、B均无明显现象,其原因是:____ ___。
(3)点燃酒精灯一段时间后,A、B中可观察到明显现象。
A中开始发生反应的化学方程式为:2Fe +6H2SO4 Fe2(SO4)3 + 3SO2↑ +6H2O
和______________________________________(写化学方程式)。
B中的现象是_________,由此可得到浓硫酸具有_______性,C装置的作用 。
(4)随着反应的进行,A中还可能发生某些离子反应。写出相应的离子方程式__ __。
(5)反应一段时间后,从A中逸出气体的速率仍然较快,除因温度较高,反应放热外,还可能的原因是_____________________________________。
Ⅱ 测定铁的质量分数
(6)待A中不再逸出气体时,停止加热,拆下E并称重。E增重b g。
铁碳合金中铁的质量分数为_____________________(写表达式),为使实验数据更为精确,可在装有碱石灰的干燥管后加入________________________________。
某化学兴趣小组为了测定某铁碳合金中铁的质量分数,并探究浓硫酸的某些性质,设计了下图所示的实验装置和实验方案(夹持仪器已省略),请据此项回答相应问题。
Ⅰ探究浓硫酸的某些性质
(1)按图示连接装置,检查装置的气密性,称量E的质量。
(2)将a g铁碳合金样品放入A中,再加入适量的浓硫酸。仪器A的名称为____________,
未点燃酒精灯前,A、B均无明显现象,其原因是:____ ___。
(3)点燃酒精灯一段时间后,A、B中可观察到明显现象。
A中开始发生反应的化学方程式为:2Fe +6H2SO4 Fe2(SO4)3 + 3SO2↑ +6H2O
Fe2(SO4)3 + 3SO2↑ +6H2O
和______________________________________ (写化学方程式)。
B中的现象是_________,由此可得到浓硫酸具有_______性,C装置的作用 。
(4)随着反应的进行,A中还可能发生某些离子反应。写出相应的离子方程式__ __。
(5)反应一段时间后,从A中逸出气体的速率仍然较快,除因温度较高,反应放热外,还可能的原因是_____________________________________。
Ⅱ测定铁的质量分数
(6)待A中不再逸出气体时,停止加热,拆下E并称重。E增重b g。
铁碳合金中铁的质量分数为_____________________(写表达式),为使实验数据更为精确,可在装有碱石灰的干燥管后加入________________________________。
某化学兴趣小组为了测定某铁碳合金中铁的质量分数,并探究浓硫酸的某些性质,设计了下图所示的实验装置和实验方案(夹持仪器已省略),请据此项回答相应问题。

Ⅰ 探究浓硫酸的某些性质
(1)按图示连接装置,检查装置的气密性,称量E的质量。
(2)将a g铁碳合金样品放入A中,再加入适量的浓硫酸。仪器A的名称为____________,
未点燃酒精灯前,A、B均无明显现象,其原因是:____ ___。
(3)点燃酒精灯一段时间后,A、B中可观察到明显现象。
A中开始发生反应的化学方程式为:2Fe +6H2SO4
 Fe2(SO4)3 + 3SO2↑ +6H2O
Fe2(SO4)3 + 3SO2↑ +6H2O
和______________________________________ (写化学方程式)。
B中的现象是_________,由此可得到浓硫酸具有_______性,C装置的作用 。
(4)随着反应的进行,A中还可能发生某些离子反应。写出相应的离子方程式__ __。
(5)反应一段时间后,从A中逸出气体的速率仍然较快,除因温度较高,反应放热外,还可能的原因是_____________________________________。
Ⅱ 测定铁的质量分数
(6)待A中不再逸出气体时,停止加热,拆下E并称重。E增重b g。
铁碳合金中铁的质量分数为_____________________(写表达式),为使实验数据更为精确,可在装有碱石灰的干燥管后加入________________________________。
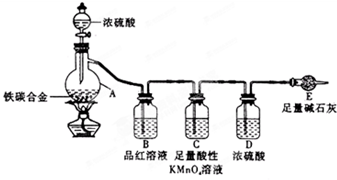 某化学兴趣小组为了测定某铁碳合金中铁的质量分数,并探究浓硫酸的某些性质,设计了如图所示的实验装置和实验方案(夹持仪器已省略),请据此项回答相应问题.
某化学兴趣小组为了测定某铁碳合金中铁的质量分数,并探究浓硫酸的某些性质,设计了如图所示的实验装置和实验方案(夹持仪器已省略),请据此项回答相应问题. Fe2(SO4)3+3SO2↑+6H2O和______ (写化学方程式).
Fe2(SO4)3+3SO2↑+6H2O和______ (写化学方程式).
本试卷分为第Ⅰ卷(选择题)和第Ⅱ卷。
第Ⅰ卷共18小题,每题6分.共108分。
一、选择题:选对的给6分,选错的或未选得给0分。
1.D 2.D 3.B 4.C 5.B 6.A 7.D 8.B 9.C 10.D 11.C 12.D
二、选择题:全部选对的给6分,选对但不全的给3分,有选错得或未选的给0分。
13.C 14.C 15.C 16.C 17.C、D 18.A
第Ⅱ卷必考部分共9题,共157分。
19.(18分)
【解析】⑴① MO的高度h,OP距离x1,O P'距离x2 (6分) ② 理科综合(三).files/image090.gif) (3分)(2)待测电阻约2kΩ,用3.7V电池供电时最大电流约
(3分)(2)待测电阻约2kΩ,用3.7V电池供电时最大电流约理科综合(三).files/image092.gif) mA,因此电流表用A1量程太大,换用A2。(3分)
mA,因此电流表用A1量程太大,换用A2。(3分)
(3)①A1损坏,A2量程太小,因此只有电压表可作测量仪器;只有一块电表时电阻应选用电阻箱或至少两只已知阻值的固定电阻,电压表测路端电压。(3分)
理科综合(三).files/image093.gif) ②由于没有电流表,所测数据为路端电压U的电阻箱的阻值R2,由
②由于没有电流表,所测数据为路端电压U的电阻箱的阻值R2,由理科综合(三).files/image095.gif) 得出:
得出:理科综合(三).files/image097.gif) (3分)
(3分)
20.(15分)
解:⑴A→C过程,由动能定理得:理科综合(三).files/image099.gif) ………… (3分)
………… (3分)
△R=
R (1-cos37°)……………… (2分) ∴ vc=
⑵在C点,由牛顿第二定律有: 理科综合(三).files/image101.gif) ……(2分)
……(2分)
∴ Fc=3936N …………………………………………………………………………( 1分)
由牛顿第三定律知,运动员在C点时轨道受到的压力大小为3936N. …………(1分)
⑶设在空中飞行时间为t,则有:tan37°=理科综合(三).files/image103.gif) ………………… ( 3分)
………………… ( 3分)
∴t = 2.5s (t =-0.4s舍去)……………………………………………………( 2分)
21.(19分)
解:(1) A物体沿斜面下滑时有
理科综合(三).files/image105.gif)
∴理科综合(三).files/image107.gif)
理科综合(三).files/image109.gif) m/s2
(1分)
m/s2
(1分)
B物体沿斜面下滑时有
理科综合(三).files/image111.gif)
∴理科综合(三).files/image113.gif)
理科综合(三).files/image115.gif) (1分)
(1分)
分析可知,撤去固定A、B的外力后,物体B恰好静止于斜面上,物体A将沿斜面向下做匀加速直线运动. (1分)
A与B第一次碰撞前的速度
理科综合(三).files/image117.gif) B的速率为零
(1分)
B的速率为零
(1分)
(2)从AB开始运动到第一次碰撞用时理科综合(三).files/image119.gif) (1分)
(1分)
两物体相碰后,A物体的速度变为零,以后再做匀加速运动,而B物体将以理科综合(三).files/image121.gif) 的速度沿斜面向下做匀速直线运动.
(1分)
的速度沿斜面向下做匀速直线运动.
(1分)
设再经t2时间相碰,则有理科综合(三).files/image123.gif) (1分)
(1分)
解之可得t2=0.8s (1分)
故从A开始运动到两物体第二次相碰,共经历时间
t=t1+t2=0.4+0.8=1.2s (1分)
(3)从第2次碰撞开始,每次A物体运动到与B物体碰撞时,速度增加量均为Δv=at2=2.5×
第一次碰后: vB1=
第二次碰后: vB2=
第三次碰后: vB3=
第n次碰后: vBn=nm/s
每段时间内,B物体都做匀速直线运动,则第n次碰前所运动的距离为
sB=[1+2+3+……+(n-1)]×t2=理科综合(三).files/image125.gif) m (n=1,2,3,…,n-1) (3分)
m (n=1,2,3,…,n-1) (3分)
A物体比B物体多运动L长度,则
sA = L+sB=[0.2+理科综合(三).files/image125.gif) ]m
(3分)
]m
(3分)
则理科综合(三).files/image128.gif) J
(2分)
J
(2分)
理科综合(三).files/image130.gif) J
(2分)
J
(2分)
22.(20分)
理科综合(三).files/image131.gif) 解:(1)如图所示,带电质点受到重力mg(大小及方向均已知)、洛伦兹力qv0B(方向已知)、电场力qE(大小及方向均未知)的作用做匀速直线运动。根据力三角形知识分析可知:当电场力方向与磁场方向相同时,场强有最小值
解:(1)如图所示,带电质点受到重力mg(大小及方向均已知)、洛伦兹力qv0B(方向已知)、电场力qE(大小及方向均未知)的作用做匀速直线运动。根据力三角形知识分析可知:当电场力方向与磁场方向相同时,场强有最小值理科综合(三).files/image050.gif) 。根据物体的平衡规律有
。根据物体的平衡规律有
理科综合(三).files/image133.gif) (2分)
(2分)
理科综合(三).files/image135.gif) (2分)
(2分)
解得理科综合(三).files/image137.gif) (1分)
(1分)
理科综合(三).files/image139.gif) (1分)
(1分)
(2)如图所示,撤去磁场后,带电质点受到重力理科综合(三).files/image141.gif) 和电场力qEmin作用,其合力沿PM方向并与v0方向垂直,大小等于
和电场力qEmin作用,其合力沿PM方向并与v0方向垂直,大小等于理科综合(三).files/image143.gif) =
=理科综合(三).files/image145.gif) ,故带电质点在与Oxz平面成
,故带电质点在与Oxz平面成理科综合(三).files/image046.gif) 角的平面内作类平抛运动。
角的平面内作类平抛运动。
由牛顿第二定律
理科综合(三).files/image148.gif)
理科综合(三).files/image149.gif) 解得
解得 理科综合(三).files/image151.gif) (2分)
(2分)
设经时间t到达Oxz平面内的点N(x,y,z),由运动的分解可得
沿v0方向 理科综合(三).files/image153.gif) (1分)
(1分)
沿PM方向 理科综合(三).files/image155.gif) (1分)
(1分)
又 理科综合(三).files/image157.gif) (2分)
(2分)
理科综合(三).files/image159.gif) (2分)
(2分)
联立解得 理科综合(三).files/image161.gif)
理科综合(三).files/image163.gif) (1分)
(1分)
则带电质点落在N(理科综合(三).files/image165.gif) ,0,
,0,理科综合(三).files/image167.gif) )点 (1分)
)点 (1分)
(或带电质点落在Oxz平面内,理科综合(三).files/image161.gif) ,
,理科综合(三).files/image163.gif) 的位置)
的位置)
(3)当电场力和重力平衡时,带点质点才能只受洛伦兹力作用做匀速圆周运动
理科综合(三).files/image169.gif) 则有:
则有:理科综合(三).files/image171.gif) (1分)
(1分)
得:理科综合(三).files/image173.gif) (1分)
(1分)
要使带点质点经过x轴,圆周的直径为理科综合(三).files/image175.gif) (1分
(1分
根据理科综合(三).files/image177.gif)
得理科综合(三).files/image179.gif) (1分)
(1分)
23.(15分)
解:理科综合(三).files/image182.gif) (1)第三周期,第ⅥA族 (2分)
(1)第三周期,第ⅥA族 (2分)
(2) 非极性 (2分), (2分),2Na2O2+2CO2 = 2Na2CO3+O2 (3分)
(3) 离子晶体 (2分) 碱性(1分)
(4) C2H6 + 18OH--14e- = 2CO32- + 12H2O (3分)
24.(15分)
解:(1)A、B、C(3分,选对1个得1分,选错1个扣1分,全题不计负分);
(2)Ag++e- =Ag;(3)1.08(1分);(4)H2-2e-==2H+。
16(除注明外每空2分):
(2)常温下,Fe被浓硫酸钝化,碳不与浓硫酸反应;品红溶液褪色;2Fe+6H2SO4(浓)理科综合(三).files/image184.jpg) Fe2(SO4)3+3SO2↑+6H2O;(或C+2H2SO4(浓)
Fe2(SO4)3+3SO2↑+6H2O;(或C+2H2SO4(浓)理科综合(三).files/image184.jpg) CO2↑+2SO2↑+2H2O);(2分)
CO2↑+2SO2↑+2H2O);(2分)
(3) 铁碳在溶液中形成原电池;Fe+2H+==Fe2++H2↑(1分);(4)×100%(2分)
(5)SO2不一定能全部被品红、KMnO4除去或E中碱石灰会吸收空气中的CO2、H2O(其
它合理的也对) (2分)
25.(15分)
理科综合(三).files/image186.gif) 解:(1)(2分)0.1 mol/L?min;
解:(1)(2分)0.1 mol/L?min;
理科综合(三).files/image188.gif) (2)(3分) (或0.17);
(2)(3分) (或0.17);
(3)(6分)①a(2分) ②(参看右图,4分)
(4)(2分)0.1mol/L<c(A)<0.2mol/L
(若答为:0<c(A)<0.2mol/L,0.1mol/L<0.4mol/L,
只给1分;其它0分) (5)(2分)B
26.(25分)
解:I.(1)_二氧化碳的固定和三碳化合物的还原 (2分) _二氧化碳的固定和三碳化合物的还原 (2分) 卡尔文循环 _,(1分)
(2)_右__ (1分) __光合作用消耗的二氧化碳由缓冲液补充,同时释放出氧气导致密闭装置内气体压强增大 ,(2分)
(3)___50 30 ,(2分)
(4)_b装置不设缓冲液,其他相同_ (2分) 黑暗_。(1分)
II.(1)蛋白质(糖蛋白)(1分) (2)虫体表面抗原的改变(1分)
(3)高(1分) 虫体每一波新抗原产生后,病人机体都会产生新的IgM,但病人产生相应抗体,在抗体歼灭(2分)
虫体之前,虫体表面抗原又发生了改变,因而病人又产生新的IgM。(2分)
(4)会 (1分) 流感病毒是单链RNA病毒,结构不稳定容易突变,表达出的表面抗原经常发生变化(2分)
(从记忆细胞和相应抗体存留时间有限等方面解释也可以,其他合理答案也给分。)
(5)因为流感病毒在一次感染过程中表面抗原一般是不会改变的,而虫体表面抗原却在不断发生改变(2分)
(其他意思表达正确即可给分。)
(
27.(15分)
解:(1)等位基因(2分) 非等位基因(2分)(2)AaBB (2分) AABb(2分)
(3)①将这两株植株分别自交(1分)。
理科综合(三).files/image190.jpg)
(甲、 乙图解各1分,图解中错1处不得分。共2分)
②分别种下自交后代,从长出的自交后代中选择具有不同优良性状的植株杂交。(1分)
理科综合(三).files/image192.jpg)
(图解1分)
③种下②的后代,让其自交,得到种子,再种下,从中选择同时具有两种优良性状的植株(aabb)(2分)。
理科综合(三).files/image194.jpg)
(图解1分)
第Ⅱ卷选考部分共5题,共35分。其中,第28、29题为物理题,第30、31题为化学题,考生从两道物理题、两道化学题中各任选一题作答,若第28、29题都作答,则按第28题计分,若第30、31题都作答,则按第30题计分;第32题为生物题,是必答题。请将答案都填写在答题卡选答区域得指定位置上。
28.(12分)
(1)D (2)A、D
29.(12分)
(1)D、E、F (2)B、C
30.(13分)
解:理科综合(三).files/image196.jpg)
31.(13分)
解:答案(1)①⑥(2分)
理科综合(三).files/image198.gif) (2)C:CH3CHO(2分)Y: (2分)
(2)C:CH3CHO(2分)Y: (2分)
理科综合(三).files/image200.gif) |
理科综合(三).files/image201.gif) |
(3) (3分)
理科综合(三).files/image203.gif) (4分)
(4分)
|