
题目列表(包括答案和解析)
| 难溶电解质 | AgI | AgOH | Ag2S | PbI2 | Pb(OH)2 | PbS |
| Ksp | 8.3×10-12 | 5.6×10-8 | 6.3×10-50 | 7.1×10-9 | 1.2×10-15 | 3.4×10-28 |
(1)pH=3的醋酸和pH=11的氢氧化钠溶液等体积混合后溶液呈 ,溶液中c(CH3COO-) c(Na+)。(填大于、小于、等于)
(2)将pH=3的硫酸溶液和pH=12的氢氧化钠溶液混和,若使混和后溶液的pH=7,则硫酸溶液和氢氧化钠溶液的体积比是_______
(3)某酸性化工废水中含有浓度约为0.01mol.L-1的Ag+、Pb2+等重金属离子。有关数据如下:
|
难溶电解质 |
AgI |
AgOH |
Ag2S |
PbI2 |
Pb(OH)2 |
PbS |
|
Ksp |
8.3×10-12 |
5.6×10-8 |
6.3×10-50 |
7.1×10-9 |
1.2×10-15 |
3.4×10-28 |
(i)在废水排放前,用沉淀法除去这两种离子, 最好加入_________(填字母序号)
A. Na2S、 B. NaOH 、 C.KI、 D.Ca(OH)2
(ii)某工程师用CaO处理上述废水后Pb2+的浓度为1.2×10-3 则此溶液的pH=____。
已知:①溶液中CrO42—显黄色,Cr2O72-显橙红色
②PbCrO4难溶于水,也难溶于强酸
③H+(aq)+OH-(aq)=H2O(l); ΔH= —a KJ/mol
3Cl2(g)+2Cr3+(aq)+16OH-(aq)=2CrO42-(aq)+6Cl-(aq)+8H2O(l);ΔH=—b KJ/mol
2CrO42-(aq)+2H+(aq)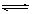 Cr2O72-(aq)+H2O(l);ΔH=—c
KJ/mol
Cr2O72-(aq)+H2O(l);ΔH=—c
KJ/mol
平衡常数K=9.5×104 (上述a、b、c均大于0)
对上述反应⑤,取50mL溶液进行试验,部分测定数据如下:
|
时间(s) |
0 |
0.01 |
0.02 |
0.03 |
0.04 |
|
n (CrO42—)(mol) |
0.01 |
8.0×10-4 |
5.4×10-4 |
5.0×10-4 |
|
|
n (Cr2O72—)(mol) |
0 |
|
4.73×10-3 |
|
4.75×10-3 |
试回答下列问题:
(1)0.02s到0.03s之间用Cr2O72-表示该反应的平均反应速率为
下列说法正确的( )
A、0.03s时V正(CrO42—)=2V逆(Cr2O72—)
B、溶液pH值不变说明该反应已达平衡状态
C、溶液中c(CrO42—):c(Cr2O72—)=2:1时该反应已达平衡状态
D、反应放热2.5×10-3c KJ时CrO42—的转化率为50%
E、升温该反应平衡常数变大
F、0.04s时加入足量的Pb(NO3)2 可使溶液由橙色变为黄色
(3)0.03s时溶液的pH=
(4)已知酸性条件下Cr2O72—将Cl-氧化为Cl2,本身被还原为Cr3+为放热反应,试写出该反应的热化学方程式:
已知:①溶液中CrO42—显黄色,Cr2O72-显橙红色
②PbCrO4难溶于水,也难溶于强酸
③H+(aq)+OH-(aq)=H2O(l); ΔH=" —a" KJ/mol
3Cl2(g)+2Cr3+(aq)+16OH-(aq)=2CrO42-(aq)+6Cl-(aq)+8H2O(l);ΔH="—b" KJ/mol
2CrO42-(aq)+2H+(aq)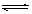 Cr2O72-(aq)+H2O(l);ΔH="—c" KJ/mol
Cr2O72-(aq)+H2O(l);ΔH="—c" KJ/mol
平衡常数K=9.5×104 (上述a、b、c均大于0)
对上述反应⑤,取50mL溶液进行试验,部分测定数据如下:
| 时间(s) | 0 | 0.01 | 0.02 | 0.03 | 0.04 |
| n (CrO42—)(mol) | 0.01 | 8.0×10-4 | 5.4×10-4 | 5.0×10-4 | |
| n (Cr2O72—)(mol) | 0 | | 4.73×10-3 | | 4.75×10-3 |
 Cr2O72-(aq)+H2O(l);ΔH="—c" KJ/mol
Cr2O72-(aq)+H2O(l);ΔH="—c" KJ/mol| 时间(s) | 0 | 0.01 | 0.02 | 0.03 | 0.04 |
| n (CrO42—)(mol) | 0.01 | 8.0×10-4 | 5.4×10-4 | 5.0×10-4 | |
| n (Cr2O72—)(mol) | 0 | | 4.73×10-3 | | 4.75×10-3 |
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
A
A
A
C
B
A
C
BC
D
D
AC
C
CD
AC
D
16.(一)ABDG (二)(1)温度对KIO3稳定性的影响?(或油炸食品是否适宜放碘盐)研究报告、实验报告、论文等.(2)IO3―+5I―+6H+====3I2+3H2O
17. (1)Zn-2e―==Zn2+,2MnO2+H2===Mn2O3+H2O
(3)①向小烧杯中加入一定量的热蒸馏水,充分搅拌,趁热过滤,将滤液冷却,再过滤得晶体,所得晶体即为ZnCl2、NH4Cl;②A.取少许溶液,加NaOH加热,在试管口放湿润红色石蕊试纸;B.试纸变蓝;C.NH4+OH―==NH3+H2O晶体混合物;D.取少许溶液,加……(或氨水),将悬浊液分成两份,一份加稀HCl,一份加足量氨水;E.先白色沉淀,后沉淀都溶解;③加热法;(4)坩埚、玻璃棒(三脚架、泥三角、坩埚钳等)
18.⑴排出装置中的空气(CO2、N2、H2O等);⑵AD,D;
⑶

⑷ 除去过量O2,保证最终收集的气体是反应生成的N2;
⑸水,若是气体,则不能被收集和测量,导致较大误差,充满水时能保证进入装置E的气体体积与排出水的体积基本相当;
⑹①使E、F中的液面相平;②视线与量筒内凹液面最低处相平,
⑺A B D;⑻不能,因为CO2、H2O会被碱石灰同时吸收,使实验结果缺少必要数据
19.⑴同周期从左→右电负性逐渐增大(或同主族……)
⑵2.0<x<2.4,弱;⑶得电子;⑷共价键
20.⑴还原剂;2Fe3++Fe==3Fe2+;⑵重结晶,FeSO4?7H2O;
⑶促进Ti4+完全水解生成沉淀;
| ||||||||||||||