
题目列表(包括答案和解析)
工业制硫酸的过程中利用反应2SO2(g)+O2(g) 2SO3(g);△H<0,将SO2转化为SO3,尾气SO2可用NaOH溶液进行吸收。请回答下列问题:
2SO3(g);△H<0,将SO2转化为SO3,尾气SO2可用NaOH溶液进行吸收。请回答下列问题:
(1)一定条件下,向一带活塞的密闭容器中充入2molSO2和1molO2发生反应,则下列说法正确的是???????????? 。
A.若反应速率v(SO2)=v(SO3),则可以说明该可逆反应已达到平衡状态
B.保持温度和容器体积不变,充入2 mol N2,化学反应速率加快
C.平衡后仅增大反应物浓度,则平衡一定右移,各反应物的转化率一定都增大
D.平衡后移动活塞压缩气体,平衡时SO2、O2的百分含量减小,SO3的百分含量增大
E.保持温度和容器体积不变,平衡后再充入2molSO3,再次平衡时各组分浓度均比原平衡时的浓度大
F.平衡后升高温度,平衡常数K增大
(2)将一定量的SO2(g)和O2(g)分别通入到体积为2L的恒容密闭容器中,在不同温度下进行反应得到如下表中的两组数据:
实验编号 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
SO2 | O2 | SO2 | O2 | |||
1 | T1 | 4 | 2 | x | 0.8 | 6 |
2 | T2 | 4 | 2 | 0.4 | y | 9 |
①实验1从开始到反应达到化学平衡时,v(SO2)表示的反应速率为????? ,表中y=???? 。
②T1?? ??? T2 ,(选填“>”、“<”或“=”),实验2中达平衡时 O2的转化率为??????? 。
(3)尾气SO2用NaOH溶液吸收后会生成Na2SO3。现有常温下0.1mol/LNa2SO3溶液,实验测定其pH约为8,完成下列问题:
①该溶液中c(Na+)与 c(OH-) 之比为?????????? 。
②该溶液中c(OH-) = c(H+)+ ??????? + ??????? (用溶液中所含微粒的浓度表示)。
③当向该溶液中加入少量NaOH固体时,c(SO32-)???? ,c(Na+)???? 。(选填“增大”、“减小”或“不变”)
(4)如果用含等物质的量溶质的下列各溶液分别来吸收SO2,则理论吸收量由多到少的顺序是 ??????????? 。
A.Na2CO3?? ???? B.Ba(NO3)2 ??? C.Na2S??? D.酸性KMnO4
工业制硫酸的过程中利用反应2SO2(g)+O2(g) 2SO3(g)+Q (Q>0),将SO2转化为SO3,尾气SO2可用NaOH溶液进行吸收。请回答下列问题:
2SO3(g)+Q (Q>0),将SO2转化为SO3,尾气SO2可用NaOH溶液进行吸收。请回答下列问题:
(1)写出该可逆反应的化学平衡常数表达式 ;
(2)一定条件下,向一带活塞的密闭容器中充入2molSO2和1molO2发生反应,下列说法中,正确的是 (填编号)。
a.若反应速率υ正(O2)=2υ逆(SO3),则可以说明该可逆反应已达到平衡状态
b.保持温度和容器体积不变,充入2 mol N2,化学反应速率加快
c.平衡后移动活塞压缩气体,平衡时SO2、O2的百分含量减小,SO3的百分含量增大
d.平衡后升高温度,平衡常数K增大
将一定量的SO2(g)和O2(g)分别通入到体积为2L的恒容密闭容器中,在不同温度下进行反应得到如下表中的两组数据:
| 实验编号 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
| SO2 | O2 | SO2 | O2 | |||
| 1 | T1 | 4 | 2 | x | 0.8 | 6 |
| 2 | T2 | 4 | 2 | 0.4 | y | t |
能源问题是人类社会面临的重大课题,甲醇是一种可再生能源,具有开发和应用的广阔前景,研究甲醇具有重要意义。
(1)用CO合成甲醇的反应为:CO(g)+2H2(g)
 CH3OH(g)在容积为1L。的密闭容器中分别充入1molCO和2molH2,实验测得甲醇的物质的量和温度、时间的关系曲线如图所示。则该正反应的△H_______0(填“<”、“>”或“=”),判断的理由是______。
CH3OH(g)在容积为1L。的密闭容器中分别充入1molCO和2molH2,实验测得甲醇的物质的量和温度、时间的关系曲线如图所示。则该正反应的△H_______0(填“<”、“>”或“=”),判断的理由是______。

(2)利用工业废气中的CO2可制取甲醇,其反应为:CO2+3H2 CH3OH+H2O。
CH3OH+H2O。
①常温常压下已知下列反应的能量变化如下图所示:

由二氧化碳和氢气制备甲醇的热化学方程式为_______。
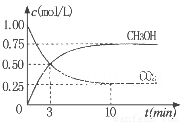
②为探究用CO2生产燃料甲醇的反应原理,现进行如下实验:在一恒温恒容密闭容器中,充入1molCO2 和3molH2,进行上述反应。测得CO2。和CH3OH(g)的浓度随时间变化如图所示。从反应开始到平衡,v(H2)=_______ ;该温度下的平衡常数数值K=______。能使平衡体系中n(CH3OH)/n(CO2))增大的措施有_______(任写一条)。
(3)工业上利用甲醇制备氢气的常用方法有两种。
①甲醇蒸汽重整法。主要反应为;CH3OH(g)
 CO(g)+2H2(g)设在容积为2.0L的密闭容器中充入0. 60
molCH3OH(g),体系压强为P1,在一定条件下达到平衡时,体系压强为P2,且P2/P1
=2.2,则该条件下CH3OH 的平衡转化率为______ 。
CO(g)+2H2(g)设在容积为2.0L的密闭容器中充入0. 60
molCH3OH(g),体系压强为P1,在一定条件下达到平衡时,体系压强为P2,且P2/P1
=2.2,则该条件下CH3OH 的平衡转化率为______ 。
②甲醇部分氧化法。在一定温度下以Ag/CeO2-ZnO为催化剂时原料气比例对反应的选择性(选择性越大,表示生成的该物质越多)影响关系如图所示。则当n(O2)/n(CH3OH) =0.25时。CH3OH与O2发生的主要反应方程式为______ 。在制备H2:时最好控制n(O2))/n(CH3OH)=______。

能源问题是人类社会面临的重大课题,甲醇是一种可再生能源,具有开发和应用的广阔前景,研究甲醇具有重要意义。
(1)用CO合成甲醇的反应为:CO(g)+2H2(g)  CH3OH(g)在容积为1L。的密闭容器中分别充入1molCO和2molH2,实验测得甲醇的物质的量和温度、时间的关系曲线如图所示。则该正反应的△H_______0(填“<”、“>”或“=”),判断的理由是______。
CH3OH(g)在容积为1L。的密闭容器中分别充入1molCO和2molH2,实验测得甲醇的物质的量和温度、时间的关系曲线如图所示。则该正反应的△H_______0(填“<”、“>”或“=”),判断的理由是______。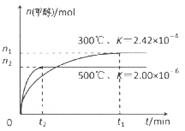
(2)利用工业废气中的CO2可制取甲醇,其反应为:CO2+3H2 CH3OH+H2O。
CH3OH+H2O。
①常温常压下已知下列反应的能量变化如下图所示:
由二氧化碳和氢气制备甲醇的热化学方程式为_______。
②为探究用CO2生产燃料甲醇的反应原理,现进行如下实验:在一恒温恒容密闭容器中,充入1molCO2和3molH2,进行上述反应。测得CO2。和CH3OH(g)的浓度随时间变化如图所示。从反应开始到平衡,v(H2)="_______" ;该温度下的平衡常数数值K=______。能使平衡体系中n(CH3OH)/n(CO2))增大的措施有_______(任写一条)。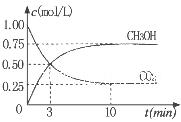
(3)工业上利用甲醇制备氢气的常用方法有两种。
①甲醇蒸汽重整法。主要反应为;CH3OH(g)  CO(g)+2H2(g)设在容积为2.0L的密闭容器中充入0. 60 molCH3OH(g),体系压强为P1,在一定条件下达到平衡时,体系压强为P2,且P2/P1 =2.2,则该条件下CH3OH 的平衡转化率为______ 。
CO(g)+2H2(g)设在容积为2.0L的密闭容器中充入0. 60 molCH3OH(g),体系压强为P1,在一定条件下达到平衡时,体系压强为P2,且P2/P1 =2.2,则该条件下CH3OH 的平衡转化率为______ 。
②甲醇部分氧化法。在一定温度下以Ag/CeO2-ZnO为催化剂时原料气比例对反应的选择性(选择性越大,表示生成的该物质越多)影响关系如图所示。则当n(O2)/n(CH3OH) =0.25时。CH3OH与O2发生的主要反应方程式为______ 。在制备H2:时最好控制n(O2))/n(CH3OH)=______。
 CH3OH(g)在容积为1L。的密闭容器中分别充入1molCO和2molH2,实验测得甲醇的物质的量和温度、时间的关系曲线如图所示。则该正反应的△H_______0(填“<”、“>”或“=”),判断的理由是______。
CH3OH(g)在容积为1L。的密闭容器中分别充入1molCO和2molH2,实验测得甲醇的物质的量和温度、时间的关系曲线如图所示。则该正反应的△H_______0(填“<”、“>”或“=”),判断的理由是______。
 CH3OH+H2O。
CH3OH+H2O。

 CO(g)+2H2(g)设在容积为2.0L的密闭容器中充入0. 60 molCH3OH(g),体系压强为P1,在一定条件下达到平衡时,体系压强为P2,且P2/P1 =2.2,则该条件下CH3OH 的平衡转化率为______ 。
CO(g)+2H2(g)设在容积为2.0L的密闭容器中充入0. 60 molCH3OH(g),体系压强为P1,在一定条件下达到平衡时,体系压强为P2,且P2/P1 =2.2,则该条件下CH3OH 的平衡转化率为______ 。
生物部分
选择题答案:1.B 2.A 3.C 4.C 5.D 6.C
30.(每空2分,共28分)
1.(1)氧气、二氧化碳 (2)叶绿体和线粒体(3)①③ (4)催化两种反应的酶不同
(5)1mol 葡萄糖分解为2mol物质A时释放了能量
Ⅱ(1)下丘脑(神经分泌)细胞 甲状腺激素 一 (2)①效应器 X、Y
化学信号②0 2
③将药物放在X点,刺激Y点,观察效应器的反应(或药物放在Y点,刺激Y点,观察电流表发生偏转情况)
31.(每空2分,共16分)
I.(1)①因为小鼠无毛性状可遗传给后代,并且在种群中常见形状为有毛。
②无毛小鼠与亲代有毛小鼠杂交后代中有毛和无毛形状没有出现性别差异。
(2)方案:让无毛小鼠与亲代有毛小鼠杂交后代中的有毛小鼠♀×无毛小鼠♂杂交
选择的理由:亲本均具正常生育能力, 后代无毛小鼠出现概率较高,为1/2 ,具有毛雌小鼠繁殖能力高,哺乳正常
(若方案为:杂合有毛小鼠♀×杂合有毛小鼠♂,后代无毛小鼠出现概率较低,为1/4:若方案为:无毛小鼠♀×杂合有毛小鼠♂或无毛小鼠♀×无毛小鼠♂,则纯合隐性毛雌鼠繁殖能力低,哺乳困难。所以不给分)
11.(1)3 2
(2)
(3)
化学部分
选择题答案:7~13:BDDCCBA
26.(12分) (1) (3分);
(3分);
 (2)
(2)
(3)
(4)
27.(12分 每空2分)
(1)①负极  (或
(或 )
)
②正极  (或
(或 )
)
(2)变蓝
28.(17分) (1)

(2)

(3)
(4) 羟基 羧基
(5)
(6) (邻、间、对均可)
(邻、间、对均可)
29(17分)(1)固体完全溶解,溶液呈血红色
(2)


 (每个离子方程式2分,共6分)
(每个离子方程式2分,共6分)
(3)取 固体粉末在空气中充分加热,待质量不再变化时,称其质量为
固体粉末在空气中充分加热,待质量不再变化时,称其质量为 ,则混合物中
,则混合物中 的质量分数为
的质量分数为
(4)①B、D ② ③加热浓缩,降温结晶
③加热浓缩,降温结晶
物理部分
选择题答案:14.A 15.C 16.A 17.B 18.BC 19.AC 20.C 21.BD
22.(17分)
 ABD(5分,部分选对得3分,有错选得0分)
ABD(5分,部分选对得3分,有错选得0分)
Ⅱ(1) (2)平衡摩擦力(表术类同均可得分) ,
(2分)
小车与砝码的总质量远大于钩码总质量或 。
。
(2)(2分)
测量点



C
5.08(1分)
0.48(1分)
0.24
(
(3)可获得的结论是外力所做的功与物理速度平方的变化成正比(2分)。
 绘图4分, 直线正确给2分,横纵坐标互换
绘图4分, 直线正确给2分,横纵坐标互换
或横坐标为S也给2分
23.(17分)
解:秋千摆的过程,由机械能守恒
可得 
解得 
在星球表面 

联立解得 

 即
即
24.(18分)
解:(1)物体开始运动,
离开墙壁时 即
即
 解得:
解得:
(2) 至
至 时间内物体处于精制状态
时间内物体处于精制状态
 至
至  时间内物体处于 变加速直线运动
时间内物体处于 变加速直线运动
 至落地时间内物体处于变加速曲线运动或
至落地时间内物体处于变加速曲线运动或
离开墙壁过程在竖直方向
解得 

25.(20分)
解:(1)线框在磁场中匀速运动,则
由公式得 


由以上四式联立解得:
由动能定理得  解得
解得
(2)由能量守恒可知:
(从电流热效应求得正确结果也给分)
(3)撤去档板后,线框在磁场中水平方向所受合力为0,竖直方向只受重力,因此,线框在穿越磁场过程作类平抛运动。
水平方向:
竖直方向:

撤去挡板前后,线框产生热量相同,即
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com