
题目列表(包括答案和解析)
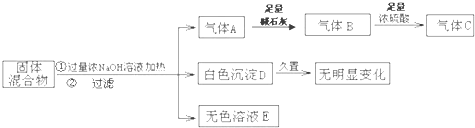
(15分)离子化合物M(化学式为NaN3)在汽车安全气囊中有重要的作用,M与其他物质的转化关系如下图所示。已知:常温下G为淡黄色固体,H为一种常见的液体,A、B、C、X为单质,其中A、C、X为气体,A、X分别为空气的主要成分之一。I、J为常见的工业原料。相关转化关系如图所示: ☆
(1)实验室中物质I应如何保存? 。
(2)写出D与X反应的化学方程式 。
(3)G,F均能氧化SO2 ,若前一反应仅生成一种盐,后一反应生成两种氧化物,写出相应化学方程式 ; 。
(4)常温下M受撞击时可分解,13gM完全分解为A和B时,放出a kJ的热量,写出M分解的热化学方程式 。
(5)M是一种易溶于水的盐,其水溶液显弱碱性,用离子方程式解释原因 。
(6)相同条件下,等体积等物质的量浓度的M溶液和NaCl溶液中,阴、阳离子总数的关系是前者 后者.(填大于、等于或小于)
(15分)离子化合物M(化学式为NaN3)在汽车安全气囊中有重要的作用,M与其他物质的转化关系如下图所示。已知:常温下G为淡黄色固体,H为一种常见的液体,A、B、C、X为单质,其中A、C、X为气体,A、X分别为空气的主要成分之一。I、J为常见的工业原料。相关转化关系如图所示: ☆
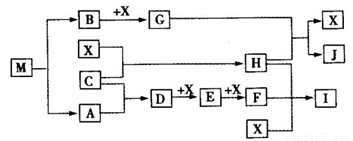
(1)实验室中物质I应如何保存? 。
(2)写出D与X反应的化学方程式 。
(3)G,F均能氧化SO2 ,若前一反应仅生成一种盐,后一反应生成两种氧化物,写出相应化学方程式 ; 。
(4)常温下M受撞击时可分解,13gM完全分解为A和B时,放出a kJ的热量,写出M分解的热化学方程式 。
(5)M是一种易溶于水的盐,其水溶液显弱碱性,用离子方程式解释原因 。
(6)相同条件下,等体积等物质的量浓度的M溶液和NaCl溶液中,阴、阳离子总数的关系是前者 后者.(填大于、等于或小于)
已知化合物A、B、M、N含有同一种元素,且A与B,M与N的元素组成相同,A与B在常温下均呈液态。D为固体单质,与X的浓溶液在常温下作用无明显现象,加热时有大量气体产生。(相关转化中所有反应物与生成物均已标出)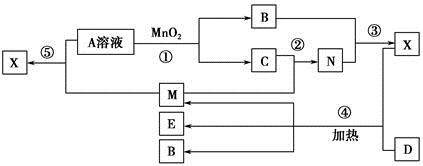
(1)若D与E溶液能够发生化合反应。且溶液在反应前后颜色有变化。
①A的电子式为________。D的化学式为________。
②M与E溶液可发生反应生成X,其离子方程式为________________________
(2)若D为常见的红色金属单质。用情性电极电解100 mL 0.05 moL·L-1E溶液,导线中通过0.08 mol电子,阳极析出的气体体积为________mL(标准状况),假设溶液体积不变,则所得溶液pH=________。
(3)若D为短周期元素形成的黑色固体单质。反应④的化学方程式为___________________________
(4)已知下列几种试剂:
a.无水CuSO4 b.品红溶液 c.酸性KMnO4溶液
d.澄清石灰水 e.饱和NaOH溶液
为了检验(3)中D与X生成的混合气体的成分,某学生用上述试剂(或部分试剂)设计了几种实验方案,下列试剂使用顺序最合理的是________(填序号)。
A.abebd B.adeb C.abcbd D.abd
已知化合物A、B、M、N含有同一种元素,且A与B,M与N的元素组成相同,A与B在常温下均呈液态。D为固体单质,与X的浓溶液在常温下作用无明显现象,加热时有大量气体产生。(相关转化中所有反应物与生成物均已标出)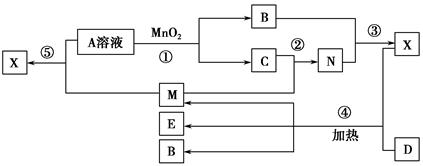
(1)若D与E溶液能够发生化合反应。且溶液在反应前后颜色有变化。
①A的电子式为________。D的化学式为________。
②M与E溶液可发生反应生成X,其离子方程式为________________________
_________________________________________________________________。
(2)若D为常见的红色金属单质。用情性电极电解100 mL 0.05 moL·L-1E溶液,导线中通过0.08 mol电子,阳极析出的气体体积为________mL(标准状况),假设溶液体积不变,则所得溶液pH=________。
(3)若D为短周期元素形成的黑色固体单质。反应④的化学方程式为_________________________________________________________________。
(4)已知下列几种试剂:
a.无水CuSO4
b.品红溶液
c.酸性KMnO4溶液
d.澄清石灰水
e.饱和NaOH溶液
为了检验(3)中D与X生成的混合气体的成分,某学生用上述试剂(或部分试剂)设计了几种实验方案,下列试剂使用顺序最合理的是________(填序号)。
A.abebd B.adeb C.abcbd D.abd
物理部分答案
一、选择题(本题共7小题。在每小题给出的四个选项中,只有一个选项正确。)
14、C 15、C 16、D 17、C 18、D 19、B 20、B
、非选择题 (共4大题,共68分)
21(18分)Ⅰ:(1)B C (4分)(2)重力的分力与摩擦力平衡,砂桶的质量远小于小车质量(2分)
 (3)B(2分)
(3)B(2分)
Ⅱ:(1)电路图如图所示(4分)
(2)若干组电流表的读数和电阻箱的读数(2分)
(3) (2分),
(2分), (2分)
(2分)
22(14分)解析:(1)设A、B的质量分别为m、M,滑到水平面上时的速度分别为vA、vB,根据机械能守恒定律得:
 ,
, ……3分
……3分
解得: ,
, ……2分
……2分
(2)设A、B两物体在斜面上运动的时间分别为tA、tB,
根据牛顿第二定律求得A、B两物体下滑的加速度均为: ……2分
……2分
由运动学公式得:vA = a tA , tA = 0.4 s ……1分
vB = a tB , tB = 0.8 s ……1分
在水平面上两物体均作匀速运动,当B追上A时有:
 ……3分
……3分
解得:t = 1.2 s ……2分
23(16分)解析:(1)ab杆匀速下滑时,流过ab杆的电流: ……2分
……2分
根据闭合电路欧姆定律得: ……2分
……2分
ab杆切割磁感线产生的感应电动势: ……1分
……1分
解得:v =
(2)金属杆匀速下滑时,速度达到最大值,即:v =
设导轨倾斜角度为θ,分析金属杆受力可得: ……2分
……2分
设ab杆开始下滑到达到最大速度的过程中的位移为x
由: ……1分
……1分
 ……1分
……1分
灯泡电阻: ……1分
……1分
解得: ……1分
……1分
由功能关系得: ……2分
……2分
解得:Q = 0.12 J ……1分
24(20分)解析:(1)小球A在电场中做类平抛运动,在电场中沿x、y轴方向上的位移分别设为x1、y1。
 ……1分,
……1分,
 …1分
…1分
 ……1分
……1分
vx = v0 , vy=at1 ……1分
解得: y1=
vy=at1=
 所以,小球A第一次进入磁场时的速度为:
所以,小球A第一次进入磁场时的速度为: ……1分
……1分
方向与y轴正方向成370 。……1分
(2)小球A在磁场中做匀速圆周运动,垂直于x轴进入第4象限,做出小球A运动的轨迹如图,设轨道半径为R1,由几何关系可得:
 (m)……2分
(m)……2分
根据: ……2分
……2分
解得: (T)……1分
(T)……1分
(3)在第4象限内A与C球发生完全非弹性碰撞,碰撞后速度设为v2,在磁场中做圆周运动的轨道半径设为R2。
 ……2分,
……2分,
 ……1分
……1分
解得: ……1分
……1分
即:小球运动的轨道半径不变
由周期公式: ……1分
……1分
可得:碰撞后小球的速度小,故碰后的周期大,所以要使小球A在第4象限内运动的时间最长,小球C应放在小球A进入第4象限时的位置: ……2分
(或由 ,可知碰后的质量大,周期大,作出判断)
,可知碰后的质量大,周期大,作出判断)
 ……1分
……1分
即坐标为(24,0)
化学部分答案
一、选择题(本题包括7小题,每小题6分,,每小题只有一项是符合题目题意)
7、B 8、B 9、A 10、D 11、C 12、B 13、B
二、填空题(本题包括四大题,共58分)
25、(14分)
(1)、离子键、共价键 (2分) 0.2NA 或1.024×1023 (2分)
(2)、Cl2+2OH-= Cl- + ClO- +H2O (2分) Cl:1s22s22p63s23p5 (2分)
(3)、 C、浓H2SO4 (各1分)(浓字没写扣1分)
(4)、2NH4Cl+Ca(OH)2 CaCl2 +2H2O+2NH3↑(2分)
CaCl2 +2H2O+2NH3↑(2分)
(5)、MnO2+4H++2Cl- Mn2++Cl2↑+2H2O (2分)(14分)
Mn2++Cl2↑+2H2O (2分)(14分)
26、(14分)
(1)N2H4(g)+ O2(g)=N2(g)+2H2O(g); △H=-534kJ/mol (2分)
(2) O2+2H2O+4 e― = 4OH― (2分)
(3)①大于(2分) ②0.25mol (2分)
(4)N2H5+ + H2O = N2H4?H2O + H+ (2分)
(5) > (2分) (6) > (2分)
27、(14分)
(1)2KClO3 2KCl+3O2↑ (2分) S+O2
2KCl+3O2↑ (2分) S+O2 SO2 ( 2分)
SO2 ( 2分)
(2)①酸性高锰酸钾溶液溶液(紫红色)褪色 (2分) ② A、C ( 2分)
(3)取滤液C,加入AgNO3溶液,若观察到白色沉淀产生,即可证明火柴头中含有氯元素。(2分)(回答加入酸化的AgNO3溶液或用HNO3酸化的AgNO3溶液均可)
(4)①ClO3¯+3NO2¯+Ag+=AgCl↓+3NO3¯ (2分) ② 50%; (2分)
28、(16分)(1)C4H8O2 (2分)
(2)HCOOCH2CH2CH3  CH3COOCH2CH3 CH3CH2COOCH3(2×2分)
CH3COOCH2CH3 CH3CH2COOCH3(2×2分)
(3)消去反应(1分) 加聚反应 (1分)
(4)

 (3×2分)
(3×2分)
(5) (2分)
(2分)
生物部分答案
一、选择题(每小题6分,共36分)
1、C 2、C 3、B 4、C 5、B 6、D
二、非选题(共计3小题,共计54分)
29、(共21分,除特别注明外,每空2分)
产氰糖苷酶 氰酸酶

 (1) 前体物质
含氰糖苷
氰化物
(3分)
(1) 前体物质
含氰糖苷
氰化物
(3分)
(2)多个基因决定一个性状 基因通过控制酶的合成控制生物的代谢从而控制生物的性状
(3)DDhh ddHH 9∶7
(4)氰酸 ddHH或ddHh(只写一种不给分)
 (5)同时加入含氰糖苷和氰酸酶 因为含氰糖苷在氰酸酶的作用下能产氰(6分)
(5)同时加入含氰糖苷和氰酸酶 因为含氰糖苷在氰酸酶的作用下能产氰(6分)
30、(共21分)(1)见右图(4分)
(2)逐渐增强(2分) 放慢(或减缓)(2分) 光照强度(或CO2浓度)(2分)
(3)①夜温的不同(2分)
②第二步:将5组绿叶蔬菜幼苗种植在相同土质中,日温控制在
第三步:一段时间后(或1个月后)分组收获绿叶蔬菜,去泥沙称重,记录并进行比较(3分)。
③那一组绿叶蔬菜重量最重,产量最高,其对应的温度即为适宜的夜温(或有两组产量相差不大,则其对应的夜温区间即为适宜的夜温范围)(3分)。
31、(共12分,每空1分)
(1)纤维素 原核生物 分解者
(2)①有多年积累的竹枝败叶处 将竹杆加工成细颗粒埋在土壤中,一段时间后从已腐烂的竹粒处(其他答案正确也给分) ②氮源 水 无机盐 竹纤维 灭菌
③稀释涂布平板
(3)基因工程 人工诱变
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com