
题目列表(包括答案和解析)
(1)按图Ⅰ中所示装置,用两种不同操作分别进行实验,观察B管中现象。
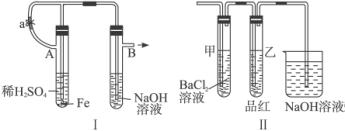
操作1:先夹紧止水夹a,再使A管开始反应,实验中在B管中观察到的现象是____________________________________________________________________。
B管中发生反应的离子方程式是______________________________________________。
操作2:打开止水夹a,使A管开始反应一段时间后再夹紧止水夹a,实验中在B管中观察到的现象是________________________________________________________________。
(2)上述装置的实验结束后,取A管内反应所得溶液,隔绝空气小心蒸干后,再高温煅烧(有关装置及操作已略去),最后留下红色固体。将分解时产生的气体按图Ⅱ所示装置依次通过洗气装置,结果试管甲内出现白色沉淀,试管乙内溶液红色褪色,回答:
①用化学方程式说明试管甲产生白色沉淀的原因(不用文字说明)____________________。
②根据实验现象,写出图Ⅰ中A管内溶液蒸干后,在高温下煅烧分解时所发生的氧化还原反应的化学方程式_____________________________________________________。
这个反应的氧化剂是_______________________,还原剂是____________________________。
根据下述实验装置和操作,回答有关问题:
(1)按图Ⅰ中所示装置,用两种不同操作分别进行实验,观察B管中现象。
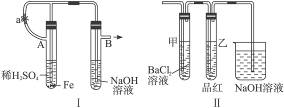
操作1:先夹紧止水夹a,再使A管开始反应,实验中在B管中观察到的现象是______________
______________________________________________________________________________。
B管中发生反应的离子方程式是___________________________________________________。
操作2:打开止水夹a,使A管开始反应一段时间后再夹紧止水夹a,实验中在B管中观察到的现象是_____________________________________________________________________。
(2)上述装置的实验结束后,取A管内反应所得溶液,隔绝空气小心蒸干后,再高温煅烧(有关装置及操作已略去),最后留下红色固体。将分解时产生的气体按图Ⅱ所示装置依次通过洗气装置,结果试管甲内出现白色沉淀,试管乙内溶液红色褪色,回答:
①用化学方程式说明试管甲产生白色沉淀的原因(不用文字说明)____________________。
②根据实验现象,写出图Ⅰ中A管内溶液蒸干后,在高温下煅烧分解时所发生的氧化还原反应的化学方程式________________________________________________________________。
这个反应的氧化剂是_______________________,还原剂是____________________________。
已知离子反应:Fe3++3SCN-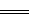 Fe(SCN)3具有反应迅速、现象明显等特点,是检验Fe3+常用的方法之一。某化学兴趣小组为探究Fe(SCN)3的性质,做了以下实验:
Fe(SCN)3具有反应迅速、现象明显等特点,是检验Fe3+常用的方法之一。某化学兴趣小组为探究Fe(SCN)3的性质,做了以下实验:
①取10 mL l mol·L-1FeCl3溶液,滴加3~4滴浓KSCN溶液,振荡后溶液立即变成红
色。
②取少量红色溶液,滴加少许浓硝酸,静置,溶液红色褪去,同时产生大量的红棕色气
体混合物A。
③将该气体混合物A通入过量的Ba(OH)2溶液中,产生白色沉淀B和剩余气体C。
气体C无色无味,能使燃烧的木条熄灭,可排放到空气中,不会改变空气的成分。
④过滤,向白色沉淀B中滴加少量稀硝酸,沉淀完全溶解,同时产生能使澄清石灰水变
浑浊的无色无味气体D。
⑤取②中反应后溶液少许,滴加BaCl2溶液,产生不溶于稀硝酸的白色沉淀E。
根据上述实验现象,回答下列问题:
(1)B的化学式为_________________;E的化学式为___________________。
(2)混合气体A的成分是___________________(填化学式)。
(3)该兴趣小组同学根据以上实验现象分析得出结论:Fe(SCN)3具有还原性,则实验②中反应时被氧化的元素是____________(填元素符号)。根据元素C、S、N的原子结构和共价键的相关知识推断出SCN-的结构式为_________________。
(4)实验②中反应的离子方程式为___________________________________________。
(5)该兴趣小组同学从上述实验中得到启发,若用SCN-间接检验Fe2+时应注意_________________________________________________________________.
(11分)离子反应是中学化学中重要的反应类型,回答下列问题:
(1)在发生离子反应的反应物或生成物中,一定存在有 (填编号)。
①单质 ②氧化物 ③化合物 ④盐
(2)可用图示的方法表示不同反应类型之间的关系。如分解反应和氧化还原反应可表示为下图。请在下面的方框中画出离子反应、置换反应和氧化还原反应三者之间的关系。
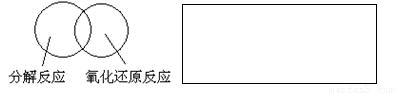 (3)有一瓶澄清的溶液,其中可能含有H+、NH+4、Mg2+、Ba2+、Al3+、I-、NO-3、CO2-3、SO2-4、AlO-2,取该溶液进行以下实验:
(3)有一瓶澄清的溶液,其中可能含有H+、NH+4、Mg2+、Ba2+、Al3+、I-、NO-3、CO2-3、SO2-4、AlO-2,取该溶液进行以下实验:
①取pH试纸检验,表明溶液呈强酸性。排除_________离子存在。
②取出部分溶液,加入少量CCl4及数滴新制氯水,经振荡后CCl4呈紫红色,可以排除 存在。
③另取部分溶液逐渐加入NaOH溶液,使溶液从酸性逐渐变为碱性,在反应过程中均无沉淀产生,则可排除_________的存在。
④取部分上述碱性溶液加Na2CO3溶液,有白色沉淀生成,证明______存在,又排除________存在。
⑤根据上述实验事实还不能确定是否存在的离子是____ ____;
根据物质的组成和性质将下列无机化合物进行了分类。
| 物质类别 | 酸 | 碱 | 盐 | 氧化物 | 氢化物 |
| 化学式 | ①H2SO4 ②______ | ③NaOH ④______ | ⑤Na2SO4 ⑥______ | ⑦SO2 ⑧Na2O | ⑨HCl ⑩_____ |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com