
题目列表(包括答案和解析)
(10分)甲、乙、丙为常见单质,乙、丙两元素在周期表中位于同一主族。X、A、B、C、D、E、F、G均为常见的化合物,其中A和X的摩尔质量相同,A、G的焰色反应为黄色。在一定条件下,各物质相互转化关系如下图。
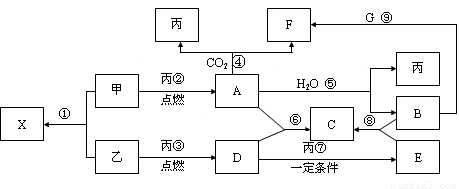
请回答:
(1) 写化学式:丙_________,E________。
(2) X的电子式为____________________。
(3)写出A与H2O反应的化学反应方程式:__________________ _____________,反应中氧化剂是__________,1molA参加反应转移电子_____mol。
(4)写出反应⑨的离子方程式:___________ _____________。
(5)物质F的俗名是__________或_________,其溶液显_____性,原因是_______________________________(用一个离子方程式表示)
已知实验室制取H2S的实验原理为FeS(块状)+H2SO4===FeSO4+H2S↑。根据下图中A~D 的实验装置和试剂进行实验:
(1)装置A是由双孔塞、玻璃导管、________和________组装起来的。
(2)组装一套制取二氧化硫气体的装置,并证明二氧化硫既有氧化性又有还原性: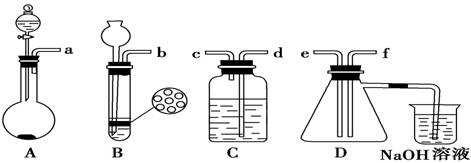
制备SO2的实验原理:Na2SO3(粉末状)+H2SO4(70%)===Na2SO4+SO2↑+H2O。
①按实验装置连接顺序:把a→f各导管口连接起来,正确的顺序是___________。
②C装置中的溶液是 ,说明二氧化硫具有 性。
(3)D中产生的现象是 ,说明二氧化硫具有 性。
(4)烧杯中发生反应的离子方程式为________________________。
(10分)甲、乙、丙为常见单质,乙、丙两元素在周期表中位于同一主族。X、A、B、C、D、E、F、G均为常见的化合物,其中A和X的摩尔质量相同,A、G的焰色反应为黄色。在一定条件下,各物质相互转化关系如下图。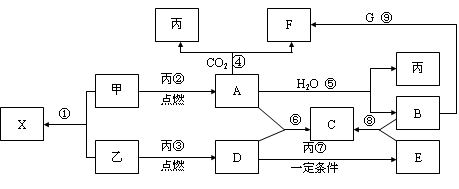
请回答:
(1)写化学式:丙_________,E________。
(2) X的电子式为____________________。
(3)写出A与H2O反应的化学反应方程式:__________________ _____________,反应中氧化剂是__________,1molA参加反应转移电子_____mol。
(4)写出反应⑨的离子方程式:___________ _____________。
(5)物质F的俗名是__________或_________,其溶液显_____性,原因是_______________________________(用一个离子方程式表示)
用离子交换法从海带中提取碘是一种较为先进的制碘工艺应用技术。
①浸泡海带:取海带500g,加13~15倍水量分两次浸泡,得浸出液6000mL左右,碘含量为0.5g/L。
②碱化浸出液除褐藻糖胶:即海带浸出液1000mL,加入浓度为40% 的NaOH溶液,控制pH值为12左右,充分搅拌后使褐藻酸钠絮状沉淀而沉降。采用倾析法分离出清液。
 ③氧化游离:向上述清液中加入浓度为6mol× L-1的H2SO4溶液,使pH值为1.5~2。往酸化后溶液中加入NaClO溶液或H2O2溶液,充分搅拌并观察溶液颜色变化。待溶液由淡黄逐渐变成棕红色即表明I-离子已转变为多碘离子(I3-)。
③氧化游离:向上述清液中加入浓度为6mol× L-1的H2SO4溶液,使pH值为1.5~2。往酸化后溶液中加入NaClO溶液或H2O2溶液,充分搅拌并观察溶液颜色变化。待溶液由淡黄逐渐变成棕红色即表明I-离子已转变为多碘离子(I3-)。
④交换吸附:氯型强碱性阴离子交换树脂(R—Cl表示)注入交换柱中(树脂层高度为12cm),如右图连接交换装置,待溶液全部通过后,树脂颜色变为黑红色。
⑤洗脱:分两步进行
第一步:取8~10% 的NaOH溶液40mL注入交换柱中。在强碱作用下,树脂颜色逐渐变浅,待树脂基本褪色后,放出溶液,收集于一小烧杯中为碱性洗脱液。
第二步:取10% 的NaCl溶液40mL注入上述交换柱中。稍待一会儿,慢慢放出溶液收集于另一小烧瓶中,为氯化钠洗脱液。
⑥往碱性洗脱液中滴加H2SO4溶液(6mol/L),烧杯底部会析出一层泥状粗碘。
⑦往氯化钠洗脱液中滴加H2SO4溶液(6mol/L)使之酸化,再滴加10% 的NaNO2溶液(在通风橱中进行)。待溶液由无色转变为棕红色直至出现棕黑色浑浊。
⑧离心分离即得粗碘。
试回答下列问题
(1)步骤③在酸性条件下用NaClO(或H2O2)氧化碘的离子方程式: ,
及I2 +I-![]() I3-。如何用化学方法检验有多碘离子生成 。
I3-。如何用化学方法检验有多碘离子生成 。
(2)第④步发生的离子反应为: 。
(3)步骤⑤洗脱时第一步发生的离子反应为(洗脱液中含有I-和IO3-离子):
;第二步洗脱发生的离子反应为: 。
(4)步骤⑦发生反应的离子方程式为 。
(12分)下图所示为实验制取纯净干燥的Cl2,并进行检验Cl2性质的实验装置。其中E瓶中放有干燥红色布条,F中为铜网,F右端出气管口附有脱脂棉。
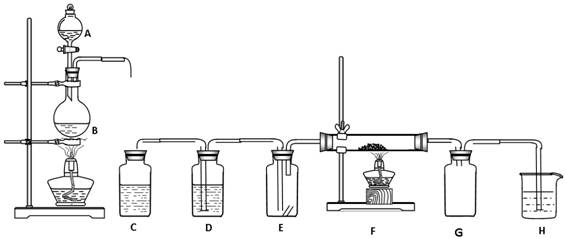
(1)洗气瓶C、D中分别盛有的试剂是 、 。
(2)E中现象是 ,
(3)F中反应的化学方程式为 。
(4)B中反应的离子方程式为 。
(5)整套装置中有两处酒精灯加热,实验时应先点燃 处的酒精灯。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com