
题目列表(包括答案和解析)
尿素(H2NCONH2)是有机态氮肥,在农业生产中有着非常重要的作用。
(1)工业上合成尿素的反应分两步进行:
第一步:2NH3(l)+CO2 H2NCOONH4(氨基甲酸铵)(l) △H1
H2NCOONH4(氨基甲酸铵)(l) △H1
第二步:H2NCOONH4 (l)  H2O+ H2NCONH2(l) △H2
H2O+ H2NCONH2(l) △H2
某化学学习小组模拟工业上合成尿素的条件,在体积为1 L的密闭容器中投入4 mol NH3和1 mol CO2,实验测得反应中各组分的物质的量随时间的变化如下图I所示。
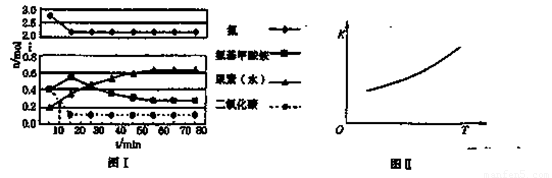
已知总反应的快慢是由较慢的一步反应决定的。则合成尿素总反应的快慢由第______步反应决定, 总反应进行到______min时到达平衡。
②第二步反应的平衡常数K随温度的变化如上右图II所示,则ΔH2______0(填“>”、“<”或“=”。)
(2)该小组将一定量纯净的氨基甲酸铵置于特制的密闭真空容器中(假设容器体积不变, 固体试样体积忽略不计),在恒定温度下使其达到分解平衡: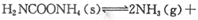
 。实验测得不同温度下的平衡数据列于下表:
。实验测得不同温度下的平衡数据列于下表:
|
温度/℃ |
15.0 |
20.0 |
25.0 |
30.0 |
35.0 |
|
平衡总压强/Kpa |
5.7 |
8.3 |
12.0 |
17.1 |
24.0 |
|
平衡气体总浓度/10-3mol/L |
2.4 |
3.4 |
4.8 |
6.8 |
9.4 |
①可以判断该分解反应已经达到化学平衡状态的标志是____________。
A.2V(NH3)=V(CO2) B.密闭容器中总压强不变
C.密闭容器中混合气体的密度不变 D.密闭容器中氨气的体积分数不变
②根据表中数据,计算25.0°C时该分解反应的平衡常数为______(保留小数点后一位)。
(3)已知:
N2(g)+O2(g)=2NO(g) △H1=+180.6KJ/mol
N2(g)+3H2(g)=2NH3(g) △H2=-92.4KJ/mol
2H2(g)+O2(g)=2H2O(g) △H3=-483.6KJ/mol
则4NO(g)+4NH3(g) +O2(g)= 4N2(g)+6 H2O(g)的△H=___kJ • mol-1。
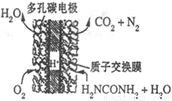
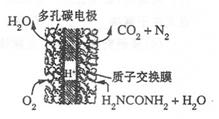
(4)尿素燃料电池的结构如图所示。其工作时 负极电极反应式可表示为______。
尿素(H2NCONH2)是有机态氮肥,在农业生产中有着非常重要的作用。
(1)工业上合成尿素的反应分两步进行:
第一步:2NH3(l)+CO2 H2NCOONH4(氨基甲酸铵)(l) △H1
H2NCOONH4(氨基甲酸铵)(l) △H1
第二步:H2NCOONH4 (l)  H2O+ H2NCONH2(l) △H2
H2O+ H2NCONH2(l) △H2
某化学学习小组模拟工业上合成尿素的条件,在体积为1 L的密闭容器中投入4 mol NH3和1 mol CO2,实验测得反应中各组分的物质的量随时间的变化如下图I所示。
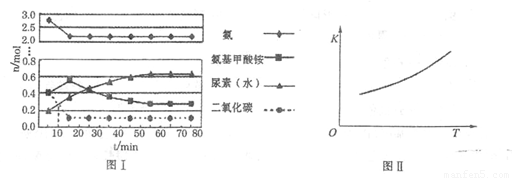
①已知总反应的快慢是由较慢的一步反应决定的。则合成尿素总反应的快慢由第______步反应决定,总反应进行到______min时到达平衡。
②第二步反应的平衡常数K随温度的变化如上右图II所示,则ΔH2______0(填“>”、“<”或“=”。)
(2)该小组将一定量纯净的氨基甲酸铵置于特制的密闭真空容器中(假设容器体积不变, 固体试样体积忽略不计),在恒定温度下使其达到分解平衡: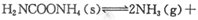
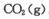 。实验测得不同温度下的平衡数据列于下表:
。实验测得不同温度下的平衡数据列于下表:
|
温度/℃ |
15.0 |
20.0 |
25.0 |
30.0 |
35.0 |
|
平衡总压强/Kpa |
5.7 |
8.3 |
12.0 |
17.1 |
24.0 |
|
平衡气体总浓度/10-3mol/L |
2.4 |
3.4 |
4.8 |
6.8 |
9.4 |
①可以判断该分解反应已经达到化学平衡状态的标志是____________。
A.2V(NH3)=V(CO2) B.密闭容器中总压强不变
C.密闭容器中混合气体的密度不变 D.密闭容器中氨气的体积分数不变
②根据表中数据,计算25.0°C时该分解反应的平衡常数为______(保留小数点后一位)。
(3)已知:
N2(g)+O2(g)=2NO(g) △H1=+180.6KJ/mol
N2(g)+3H2(g)=2NH3(g) △H2=-92.4KJ/mol
2H2(g)+O2(g)=2H2O(g) △H3=-483.6KJ/mol
则4NO(g)+4NH3(g) +O2(g)= 4N2(g)+6 H2O(g)的△H=___kJ • mol-1。
(4)尿素燃料电池的结构如图所示。其工作时 负极电极反应式可表示为______。
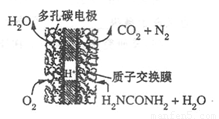
尿素(H2NCONH2)是有机态氮肥,在农业生产中有着非常重要的作用。
(1)工业上合成尿素的反应分两步进行:
第一步:2NH3(l)+CO2 H2NCOONH4(氨基甲酸铵)(l) △H1
H2NCOONH4(氨基甲酸铵)(l) △H1
第二步:H2NCOONH4 (l)  H2O+ H2NCONH2(l)△H2
H2O+ H2NCONH2(l)△H2
某化学学习小组模拟工业上合成尿素的条件,在体积为1 L的密闭容器中投入4 mol NH3和1 mol CO2,实验测得反应中各组分的物质的量随时间的变化如下图I所示。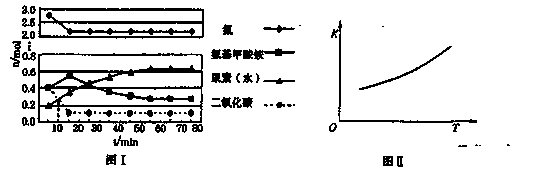
已知总反应的快慢是由较慢的一步反应决定的。则合成尿素总反应的快慢由第______步反应决定, 总反应进行到______min时到达平衡。
②第二步反应的平衡常数K随温度的变化如上右图II所示,则ΔH2______0(填“>”、“<”或“=”。)
(2)该小组将一定量纯净的氨基甲酸铵置于特制的密闭真空容器中(假设容器体积不变,固体试样体积忽略不计),在恒定温度下使其达到分解平衡: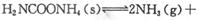
 。实验测得不同温度下的平衡数据列于下表:
。实验测得不同温度下的平衡数据列于下表:
| 温度/℃ | 15.0 | 20.0 | 25.0 | 30.0 | 35.0 |
| 平衡总压强/Kpa | 5.7 | 8.3 | 12.0 | 17.1 | 24.0 |
| 平衡气体总浓度/10-3mol/L | 2.4 | 3.4 | 4.8 | 6.8 | 9.4 |

 H2NCOONH4(氨基甲酸铵)(l) △H1
H2NCOONH4(氨基甲酸铵)(l) △H1 H2O+ H2NCONH2(l)△H2
H2O+ H2NCONH2(l)△H2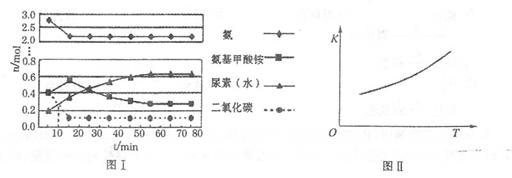
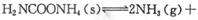
 。实验测得不同温度下的平衡数据列于下表:
。实验测得不同温度下的平衡数据列于下表:| 温度/℃ | 15.0 | 20.0 | 25.0 | 30.0 | 35.0 |
| 平衡总压强/Kpa | 5.7 | 8.3 | 12.0 | 17.1 | 24.0 |
| 平衡气体总浓度/10-3mol/L | 2.4 | 3.4 | 4.8 | 6.8 | 9.4 |
卷Ⅰ:
A卷:1.D 2.A 3.B 4.A 5.C
B卷:1.D 2.A 3.C 4.A 5.B
卷Ⅱ:
30.(22分)
Ⅰ.(10分,每空2分)
(1)少数特殊状态的叶绿素a ATP和 NADPH(缺一不给分)
(2) 0.8
(3)温度 暗
Ⅱ.(12分,每空2分)
(三)(1)促甲状腺激素释放激素
(2)甲状腺
(3)A、B两 等量的适宜浓度的促甲状腺激素
(4)促甲状腺激素释放激素
(四)A组促甲状腺激素释放激素不减少(或增加),B组促甲状腺激素释放激素减少
31.⑴ ① ③ (2分)
⑵Yy(1分)、Yy或yy(1分,缺一不给分)、yy (1分) 1/8或1/4(2分)
(3) ♀Aayy×♂AaYy (3分)
(4)第一步:选择多对的直毛棒状尾白色雌雄个体进行杂交(3分)
第二步:选择子代中的卷毛棒状尾白色的雌性个体与子代中的卷毛正常尾白色雄性个体测交(3分)
(5)①一种氨基酸可以由多个密码子决定,改变后的密码子仍决定原氨基酸(2分) ②突变发生在基因中的非编码序列(2分)
2009年高三化学一模试题参考答案:
(A卷)6.B 7.C 8.C 9.A 10.B 11.D 12.C 13.A
(B卷)6.D 7.B 8.C 9.A 10.C 11.D 12.B 13.C
26.(12分)
(1)MnO2 + 4HCl(浓) MnCl2 + 2H2O + Cl2↑
MnCl2 + 2H2O + Cl2↑
或:Cu + 2H2SO4(浓) CuSO4 + SO2↑+ 2H2O
(3分,其他合理答案也给分)
CuSO4 + SO2↑+ 2H2O
(3分,其他合理答案也给分)
(2)5Br― + BrO3― + 6H+ = 3Br2 + 3H2O(3分),溶液的酸碱性(2分)
(3)强(1分)。 因发生反应Ag+ + Cl― = AgCl↓,使得Ag+ + Fe2+ Fe3+ + Ag平衡向左移动,所以FeCl3溶液可以溶解金属银(3分)。
Fe3+ + Ag平衡向左移动,所以FeCl3溶液可以溶解金属银(3分)。
27.(16分)
(1)①②④(3分)
(2)氯气(1分);  (1分)。
(1分)。
(3)K+、Mn2+、H+ (3分)
(4)4Al + 3MnO2
 2Al2O3 + 3Mn(3分), 制备金属锰(2分)。
2Al2O3 + 3Mn(3分), 制备金属锰(2分)。
(5)2MnO2 + 2H2SO4(浓)= 2MnSO4 + 2H2O + O2↑(3分)
28.(18分)
 (1)
(1) (1分), 取代反应(水解反应)(1分)。
(1分), 取代反应(水解反应)(1分)。
(2)2CH2 = CH2 + O2 2CH3CHO(3分)。
 (3分)
(3分)
(3)5(3分) 。
 (任写一种,1分)
(任写一种,1分)
 (4)
(4)
(3分)
(5)
 (共3分)。
(共3分)。
29.(14分)
(1)在导管口将尾气点燃(2分)。
(2)撤掉酒精灯,并继续通入CO气体至固体冷却(2分)。
(3)Fe(1分),Fe3O4 (2分) (Fe3O4与FeO的混合物也对)
(4)Fe(2分), CO + 3Fe2O3 2Fe3O4
+ CO2(3分)。
2Fe3O4
+ CO2(3分)。
(5)保证铁矿石中的铁快速并完全地转化为铁单质。(2分)。



湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com