
题目列表(包括答案和解析)
某盐溶液中可能含有NH4+、Ba2+、Na+、Fe2+、Cl—、CO32—、NO3—七种离子中的数种。某同学取4份此溶液样品,分别进行了如下实验:(硝酸具有强氧化性,可以氧化Fe2+、I-、S2-、SO32—等等)
①用pH试纸测得溶液呈强酸性;
②加入 过量NaOH溶液,产生有刺激性气味的气体且有沉淀生成;
过量NaOH溶液,产生有刺激性气味的气体且有沉淀生成;
③加入硝酸酸化的AgNO3溶液产生白色沉淀;
④加足量BaCl2溶液,没有沉淀产生,在溶液中加入氯水,再滴加KSCN溶液,显红色
该同学最终确定在上述七种离子中肯定含有NH4+、Fe2+、Cl—三种离子。
请分析,该同学只需要完成上述哪几个实验,即可得出此结论。
A.①②④ B.①② C.①②③④ D.②③④
(1)(3分)食品和药品关系人的生存和健康。
①市场上销售的食盐品种很多。下列食盐中,所添加的元素不属于人体必需微量元素的是 (填字母)。
A.加锌盐 B.加碘盐 C.加钙盐
②纤维素被称为“第七营养素”。食物中的纤维素虽然不能为人体提供能量,但能促进肠道蠕动、吸附排出有害物质。从化学成分看,纤维素是一种 (填字母)。
A.多糖 B.蛋白质 C.脂肪
③某同学感冒发烧,他可服用下列哪种药品进行治疗 (填字母)。
A.麻黄碱 B.阿司匹林 C.抗酸药
(2)(5分)材料是人类赖以生存和发展的重要物质基础。
①生产硅酸盐水泥和普通玻璃都需用到的共同的主要原料是 。
②生活中有大量的铝制品。 家用铝锅不能经常用热碱水洗涤去污,原因是(用离子方程式表示) 。
家用铝锅不能经常用热碱水洗涤去污,原因是(用离子方程式表示) 。
③有机玻璃受热时会软化, 易于加工成型。有机玻璃是一种 材料(选填“硅酸盐”或“纤维”或“塑料”)。导电塑料的结构可表示为
易于加工成型。有机玻璃是一种 材料(选填“硅酸盐”或“纤维”或“塑料”)。导电塑料的结构可表示为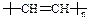 ,则其单体的结构简式为 。
,则其单体的结构简式为 。
(3)(7分)保护环境、保护地球是人类共同的呼声。
①向煤中加入石灰石作为脱硫剂,可以减少煤燃烧时产生的SO2。发生反应的化学方程式为 。
②天然水中含有的细小悬浮颗粒可以用 做混凝剂(写名称)进行净化处理。工业废水中含有的Cr3+离子,可用熟石灰作沉淀剂,在pH为8~9时生成沉淀而除去,该反应的离子方程式是 。
③城市餐饮业会产生大量污染环境的“地沟油”。“地沟油”的主要成分是油脂。综合利用“地沟油”的一种方法是将“地沟油”中的油脂水解以获取甘油和 。生活中会产生大量废弃塑料,将废弃塑料进行 处理,可以获得乙烯、丙烯等化工原料。
 过量NaOH溶液,产生有刺激性气味的气体且有沉淀生成;
过量NaOH溶液,产生有刺激性气味的气体且有沉淀生成;

 家用铝锅不能经常用热碱水洗涤去污,原因是(用离子方程式表示) 。
家用铝锅不能经常用热碱水洗涤去污,原因是(用离子方程式表示) 。 易于加工成型。有机玻璃是一种 材料(选填“硅酸盐”或“纤维”或“塑料”)。导电塑料的结构可表示为
易于加工成型。有机玻璃是一种 材料(选填“硅酸盐”或“纤维”或“塑料”)。导电塑料的结构可表示为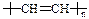 ,则其单体的结构简式为 。
,则其单体的结构简式为 。(Ⅰ)(2分)下列操作会导致实验结果偏高的是
A.配制一定物质的量浓度的硫酸溶液时,定容摇匀后,发现液面低于刻度线。
B.配制一定物质的量浓度溶液时,定容时仰视读数,所得溶液的浓度
C.用天平称量20.5g某物质,砝码和药品的位置放反,所得药品的质量
D.10%的硫酸和90%的硫酸等体积混合配制50%的硫酸溶液
(Ⅱ)(2分)化学实验中,常将溶液或试剂进行酸化,下列酸化处理的措施中正确的是
A.定性检验SO32-,可用HNO3酸化的BaCl2溶液
B. 配制FeCl2溶液时通常加少量HNO3酸化,减小其水解程度
C.检验某溶液中是否含Cl-,用HNO3酸化的AgNO3溶液
(Ⅲ)、离子反应是中学化学中重要的反应类型,回答下列问题:
(1)(2分)在发生离子反应的反应物或生成物中,一定存在有 (填编号)。
①单质 ②氧化物 ③电解质 ④盐 ⑤化合物
(2)(6分)一种无色透明溶液中,可能含有下列离子:K+、Mg2+、Al3+、Fe2+、Ba2+、NO3-、SO42-、HSO3-、HCO3-、I-和Cl-,取该溶液进行如下实验:
①将溶液滴在蓝色石蕊试纸上,呈红色。
②将少许溶液浓缩后加入铜片和硫酸,有无色气体析出,此气体通空气则立即变成红棕色。
③取少许溶液滴入BaCl2试液,则产生白色沉淀。
④取实验③中的澄清溶液,滴入AgNO3试液,产生不溶于稀HNO3的白色沉淀。
⑤另取少许溶液,滴入NaOH溶液,有白色沉淀生成,当NaOH过量时,又有部分白色沉淀溶解。
根据以上现象判断,原溶液中肯定不存在的离子是 ;肯定存在的离子是 ;不能作出判断的离子是 。
水是生命之源,它与我们的生活密切相关。在化学实验和科学研究中,水也是一种常用的试剂。
(1)水分子中氧原子在基态时核外电子排布式为 ;
(2)写出与H2O分子互为等电子体的微粒 。(写一个即可)
(3)水分子在特定条件下容易得到一个H+,形成水合氢离子(H3O+)。下列对上述过程的描述不合理的是 。
A.氧原子的杂化类型发生了改变 B.微粒的形状发生了改变
C.微粒的化学性质发生了改变 D.微粒中的键角发生了改变
(4)在冰晶体中,每个水分子与相邻的4个水分子形成氢键(如图所示),已知冰的升华热是51 kJ/mol,除氢键外,水分子间还存在范德华力(11 kJ/mol),则冰晶体中氢键的“键能”是________kJ/mol;(此时的气态水不含氢键)
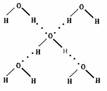
(5)将白色的无水CuSO4溶解于水中,溶液呈蓝色,是因为生成了一种呈蓝色的配位数是4的配合离子。请写出生成此配合离子的离子方程式: ______ 。
选做题
本题有A、B两题,分别对应于“物质结构与性质”和“实验化学”两个选修课程模块的内容,每题12分。请选择其中一题作答,若两题都作答,则以A题得分计入总分。
20A.过渡元素在生活、生产和科技等方面有广泛的用途。
(1)应用于合成氨反应的催化剂(铁)的表面上存在氮原子,右图为氮原子在铁的晶面上的单层附着局部示意图(图中小黑色球代表氮原子,灰色球代表铁原子)。则图示铁颗粒表面上氮原子与铁原子的个数比为 。

(2)现代污水处理工艺中常利用聚合铁{简称PFS,化学式为:[Fe2(OH)n(SO4)3-n/2]m,n<5,m<10}在水体中形成絮状物,以吸附重金属离子。下列说法中不正确的是 。(填序号)
A.PFS中铁显+3价
B.铁原子的价电子排布式是3d64s2
C.由FeSO4溶液制PFS需经过氧化、水解和聚合的过程
D.由下表可知气态Fe2+再失去一个电子比气态Mn2+再失去一个电子难
| 元素 | Mn | Fe | |
| 电离能 (kJ・mol-1) | I1 | 717 | 759 |
| I2 | 1509 | 1561 | |
| I3 | 3248 | 2957 |
(3)铬的配合物在药物应用、设计合成新磁材料领域和聚乙烯催化剂方面都有重要应用。现有铬(Ⅲ)与甲基丙烯酸根的配合物为:
①该化合物中存在的化学键类型有 。
②该化合物中一个Cr的配位数为 。
③甲基丙烯酸分子中C原子的杂化方式有 。
④等电子体是具有相同的价电子数和原子数的分子或离子,与H2O分子互为等电子体的微粒是 。(填一种即可)
⑤与铬同周期的所有元素中基态原子最外层电子数与铬原子相同的元素是
____ 。(填元素符号)
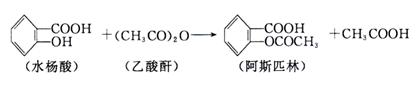 |
在生成乙酰水杨酸的同时,水杨酸分子之间也能发生聚合反应,生成少量聚合物(副产物)。合成乙酰水杨酸的实验步骤如下:
①向150mL干燥锥形瓶中加入2 g水杨酸、5 mL乙酸酐和5滴浓硫酸,振荡,待其溶解后,控制温度在85℃~90℃条件下反应5~10 min,然后冷却,即有乙酰水杨酸晶体析出。
②减压过滤,用滤液淋洗锥形瓶,直至所有晶体收集到布氏漏斗中。抽滤时用少量冷水洗涤晶体几次,继续抽滤,尽量将溶剂抽干。然后将粗产品转移至表面皿上,在空气中风干。
③将粗产品置于100 mL烧杯中,搅拌并缓慢加入25 mL饱和碳酸氢钠溶液,加完后继续搅拌2~3 min,直到没有二氧化碳气体产生为止。过滤,用5~10 mL蒸馏水洗涤沉淀。合并滤液于烧杯中,不断搅拌,慢慢加入15 mL 4mol / L盐酸,将烧杯置于冰水中冷却,即有晶体析出。抽滤,用冷水洗涤晶体1~2次,再抽干水分,即得产品。
(1)第①步中,要控制温度在85℃~90℃,应采用的加热方法是 ,用这种方法加热需要的玻璃仪器有 。
(2)在第②步中,用冷水洗涤晶体,其目的是 、 。
(3)在第③步中,加入饱和碳酸氢钠溶液的作用是 ,加入盐酸的作用是 。
(4)如何检验产品中是否混有水杨酸? 。
评分说明
1.本答案供阅卷评分时使用。考生若写出其它正确答案,可参照评分标准给分。
2.物理计算题只有最后答案而无演算过程的,不得分;只写出一般公式,但未能与试
题所给的具体条件联系的。不得分。
3.化学方程式、离子方程式未配平的,都不得分。
第I卷
第1卷共l8小题,每小题6分,共108分。
一、选择题:选对的给6分。选错或未选的给0分。
1.C 2.C 3.B 4.A 5.D 6.D 7.B 8.C 9.D 10.D 11.D 12.D
二、选择题;全部选对的给6分,选对但不全的给3分,有选错或未选的给0分。
13.B 14.C
第II卷
19.(18分)
 (1)①等间距(或均匀) ②等于
(1)①等间距(或均匀) ②等于
(2)① ,
,
②如图
③通过小灯泡的电流与电压的变化关系是非线
性关系;小灯泡的电阻随温度的升高而增大;
小灯泡的功率随电压的增大而增大等
(其他说法正确的,同样给分)
20.(15分)
汽车刹车后做匀减速直线运动,末速度为零.由运动学公式


联立解得 
由

可以判断,该车没有超速.
21.(19分)
(1)设物品质量为 ,物品先在传送带上做初速度为零的匀加速直线运动,其位移大小为
,物品先在传送带上做初速度为零的匀加速直线运动,其位移大小为 .由动能定理
.由动能定理

得

之后,物品和传送带一起以速度 做匀速运动
做匀速运动
匀加速运动的时间 
匀速运动的时间 
所以
 =
=
(2)物品在转盘上所受的静摩擦力提供向心力,当物品在转盘上恰好无相对滑动时,
有

得

22.(20分)
(1)粒子所受洛伦兹力大小

方向:正东(回答向右也给分)
(2)如图,粒子以速度为 沿地球径向射入地磁场做匀速圆周运
沿地球径向射入地磁场做匀速圆周运
 动.设半径为
动.设半径为 ,周期为
,周期为


则


由几何关系


有

(3)如图,若以最大速度 沿水平向西方射入地磁场的该种粒子不能到达地面,则
沿水平向西方射入地磁场的该种粒子不能到达地面,则
从任意方向射入地磁场的所有这种粒子均不能到达地面.设该种粒子的轨迹半径
为 ,必须满足
,必须满足

 又
又

得

25.(15分)
(1) 
酸性强弱;
(或 比
比 更容易与
更容易与 化合等合理答案)
化合等合理答案)
(2)
(3)

(4)

24.(14分)
(1)A
(2)
(3)①不是

②A
③
25.(16分)
(1)氢氧化钠(或氢氧化钾等)


(2)使 完全氧化为
完全氧化为
(3) (或其他合理答案)
(或其他合理答案)
(4)250mL容量瓶
(5)不合理,会使所测得的铁元素的质量分数偏大(或其他合理答案)
26.(25分)
I.
(1)叶绿素被破坏
(2)植物B  小 叶绿素b
小 叶绿素b
(3)50%的遮荫条件是错的,应改为黑暗条件
Ⅱ.
(1)升高 肾小管 减少
(2) 下丘脑 大脑皮层
27.(15分)
(1) 4 
(2) (或
(或 与
与 ) 1:1
) 1:1
(3) (缺一不得分)
(缺一不得分) 
(4)能
P 甲RRGgyy × ZrrggYy
↓
F Rrggyy
Rrggyy
(椭圆形、淡绿叶)
第Ⅱ卷选考部分共5题,共35分.其中,第28、29题为物理题,第30、31题为化学题,
考生从两道物理题、两道化学题中各任选一题作答,若第28、29题都作答,则按第28题计分,
若第30、31题都作答,则按第30题计分;第32题为生物题,是必答题.
28.(12分)
(1)② (2)①
29.(12分)
(1)④ (2)③
30.(13分)
(1)
金刚石是原子晶体, 是分子晶体
是分子晶体
(2)
(3)有
(4)①D
②金属键
31.(13分)
(1)羟基(或―OH)
(2) 
(3) 
(4)取代反应、加成反应
(5)3
32.(10分)
(1)乳腺 显微注射 DNA分子杂交
(2)桑椹胚(或囊胚) 胚胎分割
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com