
题目列表(包括答案和解析)
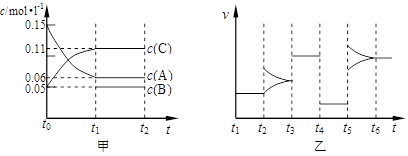
向某密闭容器中加入0.15mol/L A、0.05mol/L C和一定量的B三种气体。一定条件下发生反应,各物质浓度随时间变化如下图中甲图所示[t0时c( B)未画出,t1时增大到0.05mol/L]。乙图为 t2时刻后改变反应条件,平衡体系中正、逆反应速率随时间变化的情况。

(1)若t4时改变的条件为减小压强,则B的起始物质的量浓度为 mol/L;
该反应的平衡常数表达式为K= 。
(2)若t5时改变的条件是升温,此时v(正) > v(逆),平衡常数K的值将 (选填“增大”、“减小”或“不变”)。
(3)若 t1= 15s,则t0~ t1阶段以C 浓度变化表示的平均反应速率为v(C)=
mol/L·s。t3 时改变的某一反应条件可能是 (选填序号)。
a.使用催化剂 b.增大压强 c.增大反应物浓度 d.降低产物浓度
(4)若A的物质的量减少0.02mol时,容器与外界的热交换总量为a kJ,写出该反应的热化学方程式 。
把大气中的游离态的氮转化为氮的化合物的过程称为固氮。生物固氮和大气固氮(闪电时N2转化为NO)属于自然固氮,这远不能满足人类的需要。工业固氮(合成氨)是目前人工固氮的主要方法。有关大气固氮和工业固氮的平衡常数K值分别如下表一和表二。
表一:N2+ O2  2NO
2NO
| 温度 | 27℃ | 2000℃ |
| K值 | 3.84×10-31 | 0.1 |
 2NH3
2NH3 | 温度 | 25℃ | 350℃ | 400℃ | 450℃ |
| K值 | 5×108 | 1.847 | 0.507 | 0.152 |
 2NO是吸热反应
2NO是吸热反应
向某密闭容器中加入0.15mol/L A、0.05mol/L C和一定量的B三种气体。一定条件下发生反应,各物质浓度随时间变化如下图中甲图所示[t0时c( B)未画出,t1时增大到0.05mol/L]。乙图为 t2时刻后改变反应条件,平衡体系中正、逆反应速率随时间变化的情况。
(1)若t4时改变的条件为减小压强,则B的起始物质的量浓度为 mol/L;
该反应的平衡常数表达式为K= 。
(2)若t5时改变的条件是升温,此时v(正) > v(逆),平衡常数K的值将 (选填“增大”、“减小”或“不变”)。
(3)若 t1= 15s,则t0~ t1阶段以C 浓度变化表示的平均反应速率为v(C)=
mol/L·s。t3时改变的某一反应条件可能是 (选填序号)。
a.使用催化剂 b.增大压强 c.增大反应物浓度 d.降低产物浓度
(4)若A的物质的量减少0.02mol时,容器与外界的热交换总量为a kJ,写出该反应的热化学方程式 。
 2NO
2NO | 温度 | 27℃ | 2000℃ |
| K值 | 3.84×10-31 | 0.1 |
 2NH3
2NH3 | 温度 | 25℃ | 350℃ | 400℃ | 450℃ |
| K值 | 5×108 | 1.847 | 0.507 | 0.152 |
 2NO是吸热反应
2NO是吸热反应
一、选择题:
1、C 2、A 3、A 4、D 5、B
6-13 DBDDBADB
14.B15.AC16.AD17.C18.A19.C20.ABD21.BC
22.(17分)
|