
题目列表(包括答案和解析)
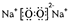
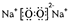


元素周期表是学习物质结构和性质的重要工具,元素周期律反映了元素性质的周期性变化规律。
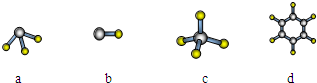
(1)元素A的原子最外层电子排布式为nsnnpn,该原子最外层共有 种不同运动状态的电子,该原子核外共有 种能量不同的电子。元素A与氢元素形成的分子,其空间结构可能是(填序号) 。
(2)下列变化规律中正确的是 。
A.金属K、Na、Mg的熔沸点由低到高
B.C1-、Br-、I-的失电子能力由弱到强
C.H+、Li+、H-的半径由大到小
D.H3PO4、HClO4、H2SO4的酸性由弱到强
(3)第二周期元素中,除Be、B、Ne三种元素外,其他元素的氢化物沸点如下表所示,其中A的电子式为 ,E的化学式为 。
| 氢化物 | A | B | HF | D | E |
| 沸点/℃ | 1317 | 100 | 19.5 | 33 | 164 |
(7分)元素周期表是学习物质结构和性质的重要工具,下面是元素周期表的一部分,表中所列字母A、D、E、G、Q、M、R、T分别代表某一化学元素。请用所给元素回答下列问题。
| A | | | |||||||||||||||
| | | | | D | E | | | | |||||||||
| G | | | Q | | M | R | | ||||||||||
| | | | | | | | T | | | | | | | | | | |
 (2)某些元素的原子可形成与Ar具有相同电子层结构的简单离子,这些离子的半径由大到小的顺序是(填离子符号) 。
(2)某些元素的原子可形成与Ar具有相同电子层结构的简单离子,这些离子的半径由大到小的顺序是(填离子符号) 。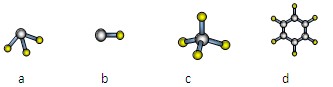
(7分)元素周期表是学习物质结构和性质的重要工具,下面是元素周期表的一部分,表中所列字母A、D、E、G、Q、M、R、T分别代表某一化学元素。请用所给元素回答下列问题。
|
A |
|
|
|||||||||||||||
|
|
|
|
|
D |
E |
|
|
|
|||||||||
|
G |
|
|
Q |
|
M |
R |
|
||||||||||
|
|
|
|
|
|
|
|
T |
|
|
|
|
|
|
|
|
|
|
(1)某元素原子的核外电子层数是最外层电子数的3倍,该元素的原子结构示意图为 。
 (2)某些元素的原子可形成与Ar具有相同电子层结构的简单离子,这些离子的半径由大到小的顺序是(填离子符号)
。
(2)某些元素的原子可形成与Ar具有相同电子层结构的简单离子,这些离子的半径由大到小的顺序是(填离子符号)
。
(3)M、D两种元素形成的化合物含有的化学键类型是 ,其分子是(填“极性”或“非极性”) 分子;
A分别与D、E、R形成的分子中,分子间存在氢键的是(填分子式) 。
A与D形成分子的空间结构可能是(填序号) 。(2分)
元素周期表是学习物质结构和性质的重要工具,元素周期律反映了元素性质的周期性变化规律。
(1)元素A的原子最外层电子排布式为nsnnpn,该原子最外层共有 种不同运动状态的电子,该原子核外共有 种能量不同的电子。元素A与氢元素形成的分子,其空间结构可能是(填序号) 。
(2)下列变化规律中正确的是 。
A.金属K、Na、Mg的熔沸点由低到高
B.C1-、Br-、I-的失电子能力由弱到强
C.H+、Li+、H-的半径由大到小
D.H3PO4、HClO4、H2SO4的酸性由弱到强
(3)第二周期元素中,除Be、B、Ne三种元素外,其他元素的氢化物沸点如下表所示,其中A的电子式为 ,E的化学式为 。
|
氢化物 |
A |
B |
HF |
D |
E |
|
沸点/℃ |
1317 |
100 |
19.5 |
33 |
164 |
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
A
B
D
C
C
B
C
D
D
C
C
B
B
A
D
16.每空2分,共8分。
(1)2ClO3-+SO2 ===2ClO2+SO42-;(2)D;(3)4.816a×1023;(4)8┱1。
17.共10分。
⑴D(1分);⑵Cu(1分);H2(1分);⑶①随着反应进行生成铝离子浓度增大,水解产生的H+的浓度增大,②该反应放热,升高温度反应加快,③铜与铝构成原电池,加快铝溶解;(3分)⑷A、B、D;(2分,少选、错选均不给分)⑸A(1分),电解质性质(1分)(其它合理解答同样给分)。
 18.共10分。
18.共10分。
⑴Na (1分) ;⑵ Cl―<S2―(1分)
⑶极性共价键(1分),非极性分子(1分);NH3(1分);c、d (1分,少选、错选均不给分) ;⑷H2S+Cl2=2HCl+S↓(2分);⑸Cl2(1分), 原子晶体(1分)。
19.每个方程式2分,其它每空1分,共8分。
⑴ade(1分,少选、错选均不给分);⑵FeCl3(1分);防止氯化亚铁被氧化(1分);Fe3++3SCN-=Fe(SCN)3(2分,合理反应都可以给分);⑶Al(OH)3(1分);Al3++3AlO2-+6H2O=4Al(OH)3↓(2分)。
20.每空1分,共11分。
【方法一】⑴分液漏斗;浓硫酸;防止外界水蒸气进入;⑵87.4% ;SO2不能完全被吸收 ,装置中有SO2滞留。
【方法二】2Na2SO3+O2=2Na2SO4
;[(
【方法三】(1)不能;酸性条件下Ba(NO3)2将SO2氧化成BaSO4;(2) 向漏斗内加水至刚好浸没沉淀,待水自然流出后再加水洗涤2~3次。
21.每空2分,共8分。
⑴3Cu2O+14H+ +2NO3- =6Cu2+ +2NO↑+7H2O;⑵32g;⑶0.2mol;⑷0.1<n<0.3。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com