
题目列表(包括答案和解析)
| 步骤Ⅰ |
| Mg,800℃,Ar |
| 步骤II |
| ||
| Ar |
| ||
| Ar |
(4分)工业上由金红石(TiO2)制取单质Ti,涉及到的步骤为:
TiO2 →(步骤Ⅰ)TiCl4 ![]() (步骤Ⅱ)Ti
(步骤Ⅱ)Ti
(1)写出步骤Ⅱ中TiCl4→Ti的化学反应方程式 。
(2)已知:①C(s)+O2(g)=CO2(g) △H=-393.5kJ?mol-1
②2CO(g)+O2(g)=2CO2(g) △H=-566kJ?mol-1
③TiO2(s)+2Cl2(g)=TiCl4(s)+O2(g) △H=+141kJ?mol-1
则反应TiO2(s)+2Cl2(g)+2C(s)=TiCl4(s)+2CO(g)的△H= kJ?mol-1。
工业上由金红石(TiO2)制取单质Ti,涉及的步骤为:
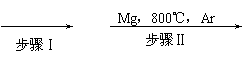
TiO2 TiCl4 Ti
(1)写出步骤ⅡTiCl4→Ti的化学方程式 。
(2)已知:①![]()
②![]()
③![]()
则反应![]() = kJ?mol-1
= kJ?mol-1
 TiCl4(l)+O2 (g);△H=+151kJ/mol反应难于发生,所以工业上不能直接由TiO2和Cl2反应来制取TiCl4.当反应体系中加入碳后,反应分如下两步进行(如果一个反应可以分几步进行,则各分步反应的反应热之和与该反应一步完成时的反应热相同).
TiCl4(l)+O2 (g);△H=+151kJ/mol反应难于发生,所以工业上不能直接由TiO2和Cl2反应来制取TiCl4.当反应体系中加入碳后,反应分如下两步进行(如果一个反应可以分几步进行,则各分步反应的反应热之和与该反应一步完成时的反应热相同). TiCl4 (l)+2CO (g);△H=
TiCl4 (l)+2CO (g);△H= TiCl4(l)+O2 (g)顺利进行的原因是
TiCl4(l)+O2 (g)顺利进行的原因是
| Mg.800℃.Ar |
一、(本题包括18小题,共54分)
1.D2.C3.D4.C5.A6.D7.B8.B9. B 10. B 11. C 12. B 13.D14.A15.A16.A17.C18.B
二、(本题包括4小题,共16分)
1.(2分)(1)N2H4(l)+2H2O2(l)= N2 (g) +4H2O (g);△H=-640 kJ?mol-1
2.(4分)(1)TiCl4+2Mg=Ti+2MgCl2(2)―80 kJ?mol-1
3.(4分)(1) 3X+Y.files\image024.gif) 2Z (2) 0.05
2Z (2) 0.05
4.(6分)①大于或等于 ② > ③ A C
三、(本题包括2小题,共14分)
1. (5分)(1)0.05mol?L-1 (2)③ ⑸
2..(9分)(1)0.25(2)[H2] = 0.016mol?L-1,[HI]= 0.0080mol?L-1
四、(本题包括2小题,共16分)
1.(8分)(1)不能(2分);因为酚酞的变色范围为8~10,即pH范围呈碱性,而BaCO3需在酸性溶液中才会不断溶解。(2分)
(2)偏高(2分);因为甲基橙的变色范围的pH为3.1~4.4,当滴定到甲基橙由黄色变到橙色时,溶液的pH已经降到4.4以下,此时已有部分BaCO3与盐酸反应,故消耗的盐酸的量偏大。(2分)
2.(8分)(1)偏低 (2分)
(2)25%(3分)
(3)37.5%(3分)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com