
题目列表(包括答案和解析)
N2(g)+3H2(g)![]() 2NH3(g)
2NH3(g)
当此反应进行到一定程度时,反应混合物就处于化学平衡状态。现在该容器中维持温度不变,令m、n、p分别代表初始加入的N2、H2和NH3的物质的量(mol),如果m、n、p取不同的数值,它们必须满足一定的关系,才能满足当达到平衡时,反应混合物中三种气体的体积分数仍跟上述平衡时的完全相同。请填写下列空白:
(1)若m=0,n=0,则p=________。
(2)若p=0.1,则m=________,n=________。
(3)m、n、p必须满足的一般条件是(请用两个方程式表示,其中一个只含m和p,另一个只含n和p):________,________。
在一定温度下,把1mol N2和3mol H2通入一个一定容积的密闭容器里,发生如下反应:
N2(g)+3H2(g)![]() 2NH3(g)
2NH3(g)
当此反应进行到一定程度时,反应混合物就处于化学平衡状态。现在该容器中维持温度不变,令m、n、p分别代表初始加入的N2、H2和NH3的物质的量(mol),如果m、n、p取不同的数值,它们必须满足一定的关系,才能满足当达到平衡时,反应混合物中三种气体的体积分数仍跟上述平衡时的完全相同。请填写下列空白:
(1)若m=0,n=0,则p=________。
(2)若p=0.1,则m=________,n=________。
(3)m、n、p必须满足的一般条件是(请用两个方程式表示,其中一个只含m和p,另一个只含n和p):________,________。
在一定温度下,把2体积N2和6体积H2通入一个带活塞的体积可变的容器中,活塞的一端与大气相通.如图所示,容器中发生反应N2(气)+3H2(气)![]() 2NH3(气)△H<0,若反应达到平衡后,测得混合气体为7体积.据此回答下列问题:
2NH3(气)△H<0,若反应达到平衡后,测得混合气体为7体积.据此回答下列问题:
(1)保持上述反应温度不变,设a、b、c分别代表初始加入的N2、H2和NH3的体积,如果反应达到平衡后混合气体体积及各物质的体积分数仍与上述平衡完全相同,那么:
①若a=1,c=2则b=________,此时该反应向________方向进行.(填“正反应”、“逆反应”)
②若规定起始时反应向逆反应进行,则c的取值范围是________.
(2)在上述装置中,若使平衡后混合气体变为6.5体积,可采取的措施是________,简述理由________.
(12分)一定温度下,在一固定体积的容器中,通入一定量的CO和H2O,
发生如下反应:CO (g) 十H2O (g)  CO2 (g) 十 H2 (g) ; △H<0
CO2 (g) 十 H2 (g) ; △H<0
(1)在850℃时,CO和H2O浓度变化如下左图,则 0~4min的平均反应速率v(CO2)= _mol·L-1·min-1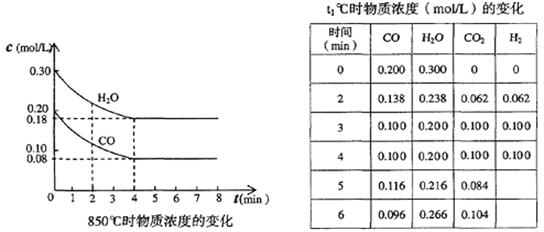
(2)t1℃时,在相同容器中发生上述反应,各物质的浓度变化如右上表:
① 计算t1℃该反应的平衡常数为K = 。
② t1℃时,反应在5min~6min间,平衡 移动(填向左、向右或不 ),若在第5分钟改变一种条件达到第6分钟的浓度,改变的条件是 ________。
(3)t2℃时,化学反应CO (g) + H2O (g)  CO2 (g) + H2 (g)的平衡浓度符合c(CO2)·c(H2)=2 c(CO)·c(H2O),则t2℃ 850℃,判断依据是:
CO2 (g) + H2 (g)的平衡浓度符合c(CO2)·c(H2)=2 c(CO)·c(H2O),则t2℃ 850℃,判断依据是:
在某温度下,体积恒定的密闭容器中加入2 molN2和4 molH2,发生如下反应:
N2(g)+3H2(g) 2NH3(g);ΔH=—92.4 kJ/mol。达到平衡时,放出热量46.2 kJ。求:
2NH3(g);ΔH=—92.4 kJ/mol。达到平衡时,放出热量46.2 kJ。求:
(1)达到平衡时,N2的转化率为_______________, NH3的体积分数为 。
(2)若向该容器中加入a mol N2、b mol H2、c mol NH3,且a、b、c均为正数,在相同条件下达到平衡时,混合物中各组分的物质的量与上述平衡相同。a、b、c取值必须满足的一般条件是 , 。
(3)科学家发明了使NH3直接用于燃料电池的方法,其装置用铂黑作电极、加入电解质溶液中,一个电极通入空气,另一电极通入NH3。其电池总反应式为:4NH3+3O2=2N2+6H2O,电解质溶液应显 (填“酸性” 、“中性” 或“碱性” ),写出正极的电极反应方程式 。
一、(本题包括18小题,共54分)
1.D2.C3.D4.C5.A6.D7.B8.B9. B 10. B 11. C 12. B 13.D14.A15.A16.A17.C18.B
二、(本题包括4小题,共16分)
1.(2分)(1)N2H4(l)+2H2O2(l)= N2 (g) +4H2O (g);△H=-640 kJ?mol-1
2.(4分)(1)TiCl4+2Mg=Ti+2MgCl2(2)―80 kJ?mol-1
3.(4分)(1) 3X+Y.files\image024.gif) 2Z (2) 0.05
2Z (2) 0.05
4.(6分)①大于或等于 ② > ③ A C
三、(本题包括2小题,共14分)
1. (5分)(1)0.05mol?L-1 (2)③ ⑸
2..(9分)(1)0.25(2)[H2] = 0.016mol?L-1,[HI]= 0.0080mol?L-1
四、(本题包括2小题,共16分)
1.(8分)(1)不能(2分);因为酚酞的变色范围为8~10,即pH范围呈碱性,而BaCO3需在酸性溶液中才会不断溶解。(2分)
(2)偏高(2分);因为甲基橙的变色范围的pH为3.1~4.4,当滴定到甲基橙由黄色变到橙色时,溶液的pH已经降到4.4以下,此时已有部分BaCO3与盐酸反应,故消耗的盐酸的量偏大。(2分)
2.(8分)(1)偏低 (2分)
(2)25%(3分)
(3)37.5%(3分)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com