
题目列表(包括答案和解析)
。 甲、乙两个研究小组,用以下两种方法由Cu粉制Cu(NO3)2溶液。
(1)甲组用a g Cu粉,在加热条件下,与空气充分反应,然后将生成的CuO全部溶于适量的稀HNO3溶液中,制得Cu(NO3)2溶液。则消耗的O2的物质的量是 ,
消耗的HNO3的物质的量是
(2)乙组用a g Cu粉全部溶于一定量的浓HNO3中,测得生成的气体在标准状况下体积为b L
(不考虑NO2转化成N2O4)。则消耗的HNO3的物质的量是 mol。
为消除污染,将生成的气体通入水中并同时通入O2,使生成的气体完全溶于水,则消耗O2的物质的量是 mol;若将生成的气体通入NaOH溶液中,气体被完全吸收,产物只有NaNO3、NaNO2和H2O,则生成NaNO2的物质的量是 mol。
Ⅰ。一定物质的量浓度溶液的配制和酸碱中和滴定是中学化学中两个典型的定量实验。某研究性学习小组在实验室中配制1mol/L的稀硫酸标准溶液,然后用其滴定某未知浓度的NaOH溶液。下列有关说法中正确的是______________(答案可能不唯一)
A、实验中所用到的滴定管、容量瓶,在使用前均需要检漏;
B、如果实验中需用60mL 的稀硫酸标准溶液,配制时应选用100mL容量瓶;
C、容量瓶中含有少量蒸馏水,会导致所配标准溶液的浓度偏小;
D、酸式滴定管用蒸馏水洗涤后,即装入标准浓度的稀硫酸,则测得的NaOH溶液的浓度将偏大;
E、用甲基橙作指示剂,滴定终点时,溶液颜色从橙色变为红色;
F、配制溶液和中和滴定的两个实验中,若在最后一次读数均俯视读数,则导致实验结果都偏大。
Ⅱ . 现用如图所示的装置制取较多量的饱和氯水并测定饱和氯水的pH。
回答有关问题:

(1)写出有关化学方程式。
装置甲:____________________________________ ;
装置丁: __________________ 。
(2)证明氯水已饱和的现象是 。
(3)制取结束时,装置丙的液体中含有的微粒是 (用微粒符号表示 );
(4)若撤去装置乙,直接将装置甲和丙相连。这样做对实验测定结果的影响是: 。
测定饱和氯水的pH方法是_______________________________________________。
Ⅲ.实验设计:证明NaOH固体在空气中放置部分变质
_______________________________________________________________
_______________________________________________________________________
Ⅰ。一定物质的量浓度溶液的配制和酸碱中和滴定是中学化学中两个典型的定量实验。某研究性学习小组在实验室中配制1mol/L的稀硫酸标准溶液,然后用其滴定某未知浓度的NaOH溶液。下列有关说法中正确的是______________(答案可能不唯一)
A、实验中所用到的滴定管、容量瓶,在使用前均需要检漏;
B、如果实验中需用60mL 的稀硫酸标准溶液,配制时应选用100mL容量瓶;
C、容量瓶中含有少量蒸馏水,会导致所配标准溶液的浓度偏小;
D、酸式滴定管用蒸馏水洗涤后,即装入标准浓度的稀硫酸,则测得的NaOH溶液的浓度将偏大;
E、用甲基橙作指示剂,滴定终点时,溶液颜色从橙色变为红色;
F、配制溶液和中和滴定的两个实验中,若在最后一次读数均俯视读数,则导致实验结果都偏大。
Ⅱ . 现用如图所示的装置制取较多量的饱和氯水并测定饱和氯水的pH。
回答有关问题:
(1)写出有关化学方程式。
装置甲:____________________________________;
装置丁: __________________ 。
(2)证明氯水已饱和的现象是 。
(3)制取结束时,装置丙的液体中含有的微粒是 (用微粒符号表示);
(4)若撤去装置乙,直接将装置甲和丙相连。这样做对实验测定结果的影响是: 。
测定饱和氯水的pH方法是_______________________________________________。
Ⅲ.实验设计:证明NaOH固体在空气中放置部分变质
_______________________________________________________________
_______________________________________________________________________
(12分);图中字母所代表的物质均为中学化学常见物质。其中A是日常生活中不可缺少的物质,也是化工生产上的重要原料;常温下C、D、H为气体单质。单质E、M、N为金属,N是地壳中含量最大的金属元素。Y是红褐色沉淀。这些物质在一定条件下存在如下转化 关系,其中有些反应物或生成物已经略去。试回答下列问题:
(1) 工业上,在电解A溶液的设备中将阴极区和阳极区用 隔开。
(2) Z→L反应的名称是 ,K的电子式为 。
(3) 写出B→F的离子方程式 。
(4) 写出K与CO2反应的化学方程式 。
(5) Y与NaClO和B混合溶液作用,是制备绿色水处理剂(Na2MO4)的一种方法,请写出有关反应的离子方程式 。
(10分);四只试剂瓶中分别盛装有NaNO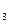 溶液、Na
溶液、Na CO
CO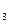 溶液、Na
溶液、Na SO
SO 溶液和NaCl溶液,就如何检验这四种溶液分别回答下列各题:
溶液和NaCl溶液,就如何检验这四种溶液分别回答下列各题:
在 四支试管中分别取四种溶液各1mL,做下列实验。
四支试管中分别取四种溶液各1mL,做下列实验。
(1)在四支试管中分别滴入 (填试剂名称),检验出的物质是 ,发生反应的化学方程式是
(2)在剩余三支试管中分别滴入 (填试剂的化学式),检验出的物质是 ,发生反应的离子方程式是
(3)在剩余两支试管中分别滴入 (填试剂的化学式),检验出的物质是
选择题(共72分)
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
18
B
D
D
C
A
B
D
C
B
A
A
C
D
D
A
B
B
C
三、填空题(本大题共2小题,共18分)
.files\image010.gif) 19. (10分)
19. (10分)
(1) 2 FeCl3+ 1
H2S 2
FeCl2+ 1 S↓+ 2 HCl
(配平2分,电子方向1分,电子个数1分)
(2) 2Fe3++H2S=2Fe2++S↓+2H+ (2分)
(3) 22.4 (2分)
(4) Cl2>Fe3+>S(2分)
20.(8分)
(1) 8∶1 4∶1 2∶1
(2) 3∶4 (每空2分)
四、推断题(本大题共2小题,共29分)
21.(13分)
(1) Na+、I-、HCO3-; Cu2+ CO32-(每填对一种离子,给1分)
(2) Cl2+2I-=2Cl-+I2 HCO3-+H+ =CO2↑+ H2O(各2分)
(3) K+(2分)
透过蓝色钴玻璃观看,若火焰呈紫色则含有K+,否则不含K+(2分)
22.(16分) (各2分)
(1) A NaHCO3 , E Na2O2
(2) 2NaHCO3.files\image011.gif)
.files\image012.gif) Na2CO3 +CO2↑ + H2O
Na2CO3 +CO2↑ + H2O
2Na2O2 +2H2O = 4Na+ +4OH―+O2↑
(3) 2OH―+CO2 = CO32―+H2O
2Na + CO32―+ CO2 + H2O = 2NaHCO3↓
Ca2++ 2OH―+ 2HCO3―=CaCO3↓+ H2O + CO32-
(4) B
五、实验题(本大题共2小题,共21分)
23.(3分)①④⑥ (少选1个扣1分,错选一个扣一分)
24.(18分)(各2分)
(1) MnO2 + 4HCl(浓).files\image011.gif)
.files\image012.gif) MnCl2
+ Cl2↑+ 2H2O
MnCl2
+ Cl2↑+ 2H2O
(2) 饱和食盐水 浓硫酸 b
Cl2 + 2OH-= Cl-+ ClO-+ H2O
(3) 铜丝剧烈燃烧,生成棕黄色的烟 能 Mg>Al>Cu
(4) Cl-+ ClO-+ 2H+=Cl2↑+ H2O
六、计算题(本大题共1小题,共10分)
25.(10分)
(1) (6分)设碳酸钠和碳酸氢钠的物质的量分别为x和y
Na2CO3 + 2HNO3 = 2NaNO3 + CO2↑+ H2O NaHCO3 + HNO3 = NaNO3 + CO2↑+ H2O
1 2 1 1 1 1
x 2 x x y y y
.files\image013.gif)
x
+ y =
解得:x = 0.05 mol y = 0.05 mol
∴ 碳酸钠和碳酸氢钠的物质的量分别为0.0500 mol和0.0500 mol
(方程式各1分,答案各2分)
(2) 消耗的硝酸的物质的量n(HNO3) = 2x + y = 0.15 mol
c(HNO3) = n(HNO3)÷V= 0.15
mol÷
(3) m(HNO3) = 0.15
mol×
m(溶液) =V?ρ= 25mL×
ω%= m(HNO3)÷m(溶液) =
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com