
题目列表(包括答案和解析)
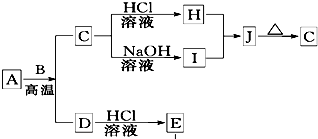 B、D是常见金属单质,A是一种红棕色金属氧化物,电解熔融态的C得到B单质,J是一种难溶于水的白色固体.
B、D是常见金属单质,A是一种红棕色金属氧化物,电解熔融态的C得到B单质,J是一种难溶于水的白色固体.
| ||
| ||
Ⅰ.A、B、C、D均是前四周期元素组成的常见不同单质或化合物。它们之间有如下转化关系:

(1)若A、B、C、D都是氧化物,且A为光导纤维的主要材料,试写出③化学反应方程式: _______???????????? __________
(2)若A、B、C、D均含有同一种常见金属元素,B是黑色磁性固体,D是一种红褐色沉淀,反应②在常见稀酸中进行,C是该反应中生成的唯一盐,反应②的离子方程式是________ _______, C盐水溶液PH______7 (填“>”“<”“ =”)。
(3)若A、B、C、D均含有同一种短周期的金属元素,且B和D在溶液中反应生成沉淀C,则下列判断正确的是______(填“小写”字母)。
a.A可能是一种耐火材料;
b.B的溶液一定呈碱性;
c.C 一定既溶于盐酸又溶于苛性钠溶液;?
若A为金属单质,则用1molA金属制备C,最少需_____mol HCl和_____mol NaOH。
Ⅱ.汽车安全气囊是行车安全的重要保障。当车辆发生碰撞的瞬间,安全装置通电点火使其中的固体粉末释放出大量的氮气形成气囊,从而保护司机及乘客免受伤害。为研究安全气囊工作的化学原理,取安全装置中的固体粉末进行实验。经组成分析,确定该粉末仅含有Na、Fe、N、O四种元素。水溶性实验表明,固体粉末部分溶解。经检测,可溶物为化合物甲,不溶物为红棕色固体,可溶于盐酸。取13.0g化合物甲(摩尔质量为65g/ mol),加热使其完全分解,生成氮气和单质乙,生成的氮气折合成标准状况下的体积为6.72L。单质乙在高温隔绝空气的条件下与不溶物红棕色粉末反应生成一种碱性氧化物丙和另一种单质。化合物丙与空气接触可转化为可溶性盐。
请回答下列问题:
(1)甲受热分解的化学方程式为??????????????????? 。
(2)丙的电子式为??????????? 。
(3)以下物质中,有可能作为安全气囊中红棕色粉末替代品的是??????????? 。
A.KCl??????????? B.KOH?????????? C.Na2S????????????? D.CuO
Cl2、HCl的混合气体通入足量的氢氧化钠溶液,充分反应后分析产物溶液中除大量
OH− 外,还有Cl−、ClO−、ClO3−,并知这三种离子的物质的量比为9:2:1。
外,还有Cl−、ClO−、ClO3−,并知这三种离子的物质的量比为9:2:1。
试问原混合气体中Cl2与HCl体积比为( )
A.2:5
B.3:1  C.5:2
D.1:1
C.5:2
D.1:1
Na2O2、HCl、Al2O3三种物质在水中完全反应后,溶液中只含有Na+、H+、Cl―、OH―;且溶液呈中性,则Na2O2、HCl、Al2O3的物质的量之比可能为
A.2︰4︰1 B.3︰2︰1 C. 2︰3︰1 D.4︰2︰1
Cl2、HCl的混合气体通入足量的氢氧化钠溶液,充分反应后分析产物溶液中除大量OH−外,还有Cl−、ClO−、ClO3−,并知这三种离子的物质的量比为9:2:1。试问原混合气体中Cl2与HCl体积比为
A.2:5 B.3:1 C.5:2 D.1:1
选择题(1―10题每小题2分,11-25题每小题3分,共65分)
题目
1
2
3
4
5
6
7
8
9
10
11
12
13
答案
B
D
C
B
D
A
B
D
A
A
D
A
C
题目
14
15
16
17
18
19
20
21
22
23
24
25
答案
C
B
C
D
B
A
C
C
B
D
C
C
三、填空题(共35分,除注明分数外,其余每个给分点为1分)
26.(6分)(1)10+m 8 (2)28+n 36 (3)离子键 (4)

27.(9分)(1)Mg O (2)Na>Mg>C>O>H (3)Mg(OH)2<NaOH
(4)H2O2、Na2O2、O3、C(活性炭)等任意三个
(5)(2分)NaHCO3+H2O NaOH+H2CO3
NaOH+H2CO3
28.(7分)(1)Cu2+、Ba2+、Fe3+ (2)AlO2-、HCO3-、SO42-、Na+
29.(13分)(1)H2O2 MnO2
(2)2KMnO4+16HCl==2KCl+2MnCl2+5Cl2↑+8H2O 溶液由无色变橙色
(3)①CaO+H2O==Ca(OH)2,反应放热,NH3?H2O NH3↑+H2O
NH3↑+H2O
②用玻璃棒蘸取少许浓盐酸靠近收集NH3的烧瓶口,若产生白烟,说明烧瓶已收集满NH3,反之,则没有收集满或用湿润的红色石蕊试纸变蓝,则说明NH3已收集满,反之,则没有收集满
(4)①挤出胶头滴管中的水(1分),打开止水夹(1分),
极易溶解于水(1分)和其水溶液呈碱性(1分)
② (2分)
(2分)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com