
题目列表(包括答案和解析)
25℃时,在20ml 0.1mol?L-1NaOH溶液中逐滴加入0.2mol?L-1醋酸溶液,曲线如图所示,有关粒子浓度关系的比较 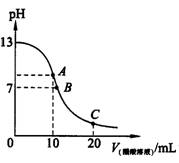 中,不正确的是
中,不正确的是
A.在A点:![]()
B.在B点:![]()
C.在C点:![]()
D.在C点:![]()
(12分)(1)在25℃条件下将pH=11的氨水稀释100倍后溶液的pH为(填序号)__ __。
A.9 B.13 C.11~13之间 D.9~11之间
(2)25℃时,向0.1mol/L的氨水中加入少量氯化铵固体,当固体溶解后,测得溶液pH减小,主要原因是(填序号)__ ___。
A.氨水与氯化铵发生化学反应
B.氯化铵溶液水解显酸性,增加了c(H+)
C.氯化铵溶于水,电离出大量铵离子,抑制了氨水的电离,使c(OH)减小
(3)室温下,如果将0.1mol NH4Cl和0.05mol NaOH全部溶于水,形成混合溶液(假设无损失),
①__ 和_ __两种粒子的物质的量之和等于0.1mol。
②_ __和_ __两种粒子的物质的量之和比OH多0.05mol。
(4)已知氨水的电离度与醋酸的电离度在同温同浓度下相等,溶有一定量氨的氯化铵溶液呈碱性。现向少量的Mg(OH)2悬浊液中,加入适量的饱和氯化铵溶液,固体完全溶解。
甲同学的解释是.
Mg(OH)2(固) ![]() Mg2++2OH-……①
Mg2++2OH-……①
NH4++H2O ![]() NH3?H2O+H+……②
NH3?H2O+H+……②
H++![]() H2O……③
H2O……③
由于NH4+水解显酸性,H+与OH-反应生成水,导致反应①平衡右移,沉淀溶解;
乙同学的解释是.
Mg(OH)2(固) ![]() Mg2++2OH-……① NH4++
Mg2++2OH-……① NH4++![]() NH3?H2O……②
NH3?H2O……②
由于NH4Cl电离出的NH4+与Mg(OH)2电离出的OH-结合,生成了弱的电解质NH3?H2O,导致反应①的平衡右移,Mg(OH)2沉淀溶解。
①丙同学不能肯定哪位同学的解释合理,于是选用下列的一种试剂加入Mg(OH)2悬浊液中,来证明甲、乙两位同学的解释只有一种正确,他选用的试剂是___________(填写编号)。
A.NH4NO3 B.CH3COONH4 C.Na2CO3 D.NH3?H2O
②丙同学将所选试剂滴入Mg(OH)2的悬浊液中,Mg(OH)2溶解;由此推知,甲和乙哪位同学的解释更合理___________(填“甲”或“乙”);完成NH4Cl饱和溶液使Mg(OH)2溶解的离子方程式___________________。
(08温州市十校联合体联考)25℃时,在20ml 0.1mol?L-1NaOH溶液中逐滴加入0.2mol?L-1醋酸溶液,曲线如图所示,有关粒子浓度关系的比较中,不正确的( )
A.在A点:c(Na+)c(OH-)c(CH3COO-)c(H+)
B.在B点:c(OH-)c(H+),c(Na+)c(CH3COO-)
C.在C点:c(CH3COO-)c(Na+)c(H+) c(OH-)
D.在C点:c(CH3COO-)+c(CH3COOH)2 c(Na+)
下列选项中的两量,前者大于后者的是( )
A.在同温同浓度的条件下,NaHSO4和NaHCO3溶液中水的电离程度
B.同温下,浓度均为0.1mol?L―1的Na2S2O3溶液和稀盐酸各10毫升和各20毫升混合 后的反应速率(Na2S2O3+2HCl 2NaCl+S↓+SO2↓+H2O
C.将pH=4的盐酸和醋酸分别稀释成pH=5的溶液,所加水的量
D.将质量和质量分数都相同的两种溶液混合:(1)NaOH+H2SO4;(2)NaOH+HCl,混合后所得溶液的pH
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com