
题目列表(包括答案和解析)
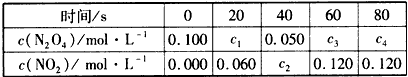
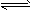 2NO2(g) 的平衡常数为_______,N2O4的转化率为______。
2NO2(g) 的平衡常数为_______,N2O4的转化率为______。根据以下3个热化学方程式:
2H2S(g)+3O2(g)=2SO2(g)+2H2O(1) △H=-akJ·mol-1
2H2S(g)+O2(g)=2S(s)+2H2O(1) △H=-bkJ·mol-1
2H2S(g)+O2(g)=2S(s)+2H2O(g) △H=-ckJ·mol-1 (a、b、c均为正数)
对a、b、c三者大小关系的判断正确的是
A.a>b>c B.a>c>b C.c>b>a D.b>a>c
根据以下三个热化学方程式:
2H2S(g)+3O2(g) → 2SO2(g)+2H2O(1)+akJ
2H2S(g)+O2(g) → 2S(s)+2H2O(1)+bkJ
2H2S(g)+O2(g) → 2S(s)+2H2O(g)+ckJ(a、b、c均为正数)
对a、b、c三者大小关系的判断正确的是( )
A.a>b>c B.a>c>b C.c>b>a D.b>a>c
根据以下3个热化学方程式:
2H2S(g)+3O2(g)=2SO2(g)+2H2O(1) △H=-akJ·mol-1
2H2S(g)+O2(g)=2S(s)+2H2O(1) △H=-bkJ·mol-1
2H2S(g)+O2(g)=2S(s)+2H2O(g) △H=-ckJ·mol-1 (a、b、c均为正数)
对a、b、c三者大小关系的判断正确的是
A.a>b>c B.a>c>b C.c>b>a D.b>a>c
金属钨用途广泛,主要用于制造硬质或耐高温的合金,以及灯泡的灯丝。高温下,在密闭容器中用H2还原WO3可得到金属钨,其总反应为:
WO3 (s) + 3H2
(g)  W (s) + 3H2O
(g)
W (s) + 3H2O
(g)
请回答下列问题:
⑴上述反应的化学平衡常数表达式为___________________________。
⑵某温度下反应达平衡时,H2与水蒸气的体积比为2:3,则H2的平衡转化率为_____________________;随温度的升高,H2与水蒸气的体积比减小,则该反应为反应_____________________(填“吸热”或“放热”)。
⑶上述总反应过程大致分为三个阶段,各阶段主要成分与温度的关系如下表所示:
|
温度 |
25℃ ~ 550℃ ~ 600℃ ~ 700℃ |
|
主要成份 |
WO3 W2O5 WO2 W |
第一阶段反应的化学方程式为___________________________;580℃时,固体物质的主要成分为________;假设WO3完全转化为W,则三个阶段消耗H2物质的量之比为____________________________________。
⑷ 已知:温度过高时,WO2 (s)转变为WO2 (g);
WO2 (s) + 2H2
(g)  W
(s) + 2H2O (g);ΔH = +66.0 kJ·mol-1
W
(s) + 2H2O (g);ΔH = +66.0 kJ·mol-1
WO2 (g) + 2H2(g)
 W
(s) + 2H2O (g);ΔH = -137.9 kJ·mol-1
W
(s) + 2H2O (g);ΔH = -137.9 kJ·mol-1
则WO2 (s)  WO2
(g) 的ΔH = ______________________。
WO2
(g) 的ΔH = ______________________。
⑸ 钨丝灯管中的W在使用过程中缓慢挥发,使灯丝变细,加入I2可延长灯管的使用寿命,其工作原理为:W (s) +2I2
(g) 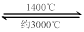 WI4
(g)。下列说法正确的有____________。
WI4
(g)。下列说法正确的有____________。
a.灯管内的I2可循环使用
b.WI4在灯丝上分解,产生的W又沉积在灯丝上
c.WI4在灯管壁上分解,使灯管的寿命延长
d.温度升高时,WI4的分解速率加快,W和I2的化合速率减慢
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com