
题目列表(包括答案和解析)
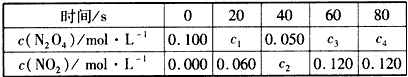
 2NO2(g) 的平衡常数为_______,N2O4的转化率为______。
2NO2(g) 的平衡常数为_______,N2O4的转化率为______。根据以下3个热化学方程式:
2H2S(g)+3O2(g)=2SO2(g)+2H2O(l) △H =―Q1 kJ·mol-1
2H2S(g)+O2(g)=2S (s)+2H2O(l) △H =―Q2 kJ·mol-1
2H2S(g)+O2(g)=2S (s)+2H2O(g) △H =―Q3 kJ·mol-1
判断Q1、Q2、Q3三者关系正确的是( )
A. Q1>Q2>Q3 B. Q1>Q3>Q2 C. Q3>Q2>Q1 D. Q2>Q1>Q3
(14分)金属钨用途广泛,主要用于制造硬质或耐高温的合金,以及灯泡的灯丝。高温下,在密闭容器中用H2还原WO3可得到金属钨,其总反应为:
WO3 (s) + 3H2 (g)  W (s) + 3H2O (g)
W (s) + 3H2O (g)
请回答下列问题:
⑴ 上述反应的化学平衡常数表达式为___________________________。
⑵ 某温度下反应达平衡时,H2与水蒸气的体积比为2:3,则H2的平衡转化率为_____________________;随温度的升高,H2与水蒸气的体积比减小,则该反应为___________反应(填“吸热”或“放热”)。
⑶上述总反应过程大致分为三个阶段,各阶段主要成分与温度的关系如下表所示:
| 温度 | 25℃ ~ 550℃ ~ 600℃ ~ 700℃ |
| 主要成份 | WO3 W2O5 WO2 W |
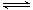 W (s) + 2H2O (g) ΔH= +66.0 kJ·mol-1
W (s) + 2H2O (g) ΔH= +66.0 kJ·mol-1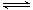 W (s) + 2H2O (g) ΔH = -137.9 kJ·mol-1
W (s) + 2H2O (g) ΔH = -137.9 kJ·mol-1 WO2 (g) 的ΔH = ______________________。
WO2 (g) 的ΔH = ______________________。 WI4 (g)。下列说法正确的有________________。
WI4 (g)。下列说法正确的有________________。根据以下3个热化学方程式:
2H2S(g)+3O2(g)=2SO2(g)+2H2O(l) △H=Q1 kJ·mol-1
2H2S(g)+O2(g)=2S (s)+2H2O(l) △H=Q2 kJ·mol-1
2H2S(g)+O2(g)=2S (s)+2H2O(g) △H=Q3 kJ·mol-1
判断Q1、Q2、Q3三者关系正确的是( )
A. Q1>Q2>Q3 B.Q1>Q3>Q2
C. Q3>Q2>Q1 D. Q2>Q1>Q3
资源化利用二氧化碳不仅可减少温室气体的排放,还可重新获得燃料或重要工业产品。
(1)有科学家提出可利用FeO吸收和利用CO2,相关热化学方程式如下:6FeO(s)+CO2(g)=2Fe3O4(s)+C(s) △H=-76.0 kJ·mol一1
①上述反应中每生成1 mol Fe3O4,转移电子的物质的量为_______mol。
②已知:C(s)+2H2O(g)=CO2(g)+2H2(g) △H=+113.4 kJ·mol一1,则反应:3FeO(s)+ H2O(g)= Fe3O4(s)+ H2(g)的△H=__________。
(2)在一定条件下,二氧化碳转化为甲烷的反应如下:CO2(g)+4 H2 (g)  C H4 (g)+2 H2O(g),向一容积为2 L的恒容密闭容器中充人一定量的CO2和H2,在300℃时发生上述反应,达到平衡时各物质的浓度分别为CO2
0.2 mol·L一1,H2
0.8 mol·L一1,CH40.8
mol·L一1,H2O1.6
mol·L一1。则CO2的平衡转化率为________。300 ℃时上述反应的平衡常数K=____________________。200℃时该反应的平衡常数K=64.8,则该反应的△H_____(填“>’’或“<”)O。
C H4 (g)+2 H2O(g),向一容积为2 L的恒容密闭容器中充人一定量的CO2和H2,在300℃时发生上述反应,达到平衡时各物质的浓度分别为CO2
0.2 mol·L一1,H2
0.8 mol·L一1,CH40.8
mol·L一1,H2O1.6
mol·L一1。则CO2的平衡转化率为________。300 ℃时上述反应的平衡常数K=____________________。200℃时该反应的平衡常数K=64.8,则该反应的△H_____(填“>’’或“<”)O。
(3)华盛顿大学的研究人员研究出一种方法,可实现水泥生产时CO2零排放,其基本原理如
图所示:
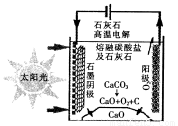
①上述生产过程的能量转化方式是____________________。
②上述电解反应在温度小于900℃时进行,碳酸钙先分解为CaO和CO2,电解质为熔融碳酸钠,则阳极的电极反应式为___________________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com