
题目列表(包括答案和解析)
(14分)运用化学反应原理研究氮、氧等单质及其化合物的反应有重要意义。
(1)合成氨反应 N2(g)+3H2(g)![]() 2NH3(g),若在恒温、恒压条件下向平衡体系中通入氩气,平衡_________移动(填“向左”“向右”或“不”);使用催化剂_________反应的△H(填“增大”“减小”或“不变”)。
2NH3(g),若在恒温、恒压条件下向平衡体系中通入氩气,平衡_________移动(填“向左”“向右”或“不”);使用催化剂_________反应的△H(填“增大”“减小”或“不变”)。
(2)已知:O2(g) = O2+(g)+e- ![]() H1= 1175.7 kJ?mol-1
H1= 1175.7 kJ?mol-1
PtF6(g) +e- = PtF6(g) ![]() H2= -771.1 kJ?mol-1
H2= -771.1 kJ?mol-1
O2+ PtF6(s)= O2+(g)+ PtF6(g) ![]() H3= 482.2 kJ?mol-1
H3= 482.2 kJ?mol-1
则反应O2(g)+ PtF6(g) = O2+ PtF6(s) 的![]() H=_____________ kJ?mol-1。
H=_____________ kJ?mol-1。
(3)在25℃下,向浓度均为0.1 mol?L-1的MgCl2和CuCl2混合溶液中逐滴加入氨水,先生成__________沉淀(填化学式),生成该沉淀的离子方程式为____________。已知25℃时Ksp[Mg(OH)2]=1.8×10-11,Ksp[Cu(OH)2]=2.2×10-20。
(4)在25℃下,将a mol?L-1的氨水与0.01 mol?L-1的盐酸等体积混合,反应时溶液中c(NH4*)=c(Cl-)。则溶液显_____________性(填“酸”“碱”或“中”);用含 a 的代数式表示NH3?H2O的电离常数Kb=__________。
运用化学反应原理研究氮、氧等单质及其化合物的反应有重要意义。
(1)合成氨反应N2 (g)+3H2(g)![]() 2NH3(g),若在恒温、恒压条件下向平衡体系中通入氩气,则平衡
2NH3(g),若在恒温、恒压条件下向平衡体系中通入氩气,则平衡
移动(填“向左”“向右”或“不”);使用催化剂,上述反应的△H________(填“增大” “减小” 或“不改变”)。
(2)甲烷在高温下与水蒸气反应的方程式为:CH4+H2O=CO+3H2。已知部分物质燃烧的热化学方程式如下:
2H2(g)+O2(g)=2H2O(l) △H=-571.6kJ?mol-1
2CO(g)+O2(g)=2CO2(g) △H=-566kJ?mol-1
CH4(g)+2O2(g)=CO2(g)+2H2O(l) △H=-890.3kJ?mol-1
又知1molH2O(g)转变为1mol H2O(l)时放出44.0kJ热量。写出CH4和H2O在高温下反应的热化学方程式 。
(3)在25℃下,向浓度均为0.1 mol?L-1的MgCl2和CuCl2混合溶液中逐滴加入氨水,先生成__________沉淀(填化学式),生成该沉淀的离子方程式为____________。已知25℃时Ksp[Mg(OH)2]=1.8×10-11,KsP [Cu(OH)2]=2.2×10-20。
(4)有人设想寻求合适的催化剂和电极材料,以N2、H2为电极反应物,以HCl―NH4Cl为电解质溶液制造新型燃烧电池。请写出该电池的正极反应式 。
(5)某温度(t℃)时,测得0.01mol?L-1的NaOH溶液的pH=11。在此温度下,将pH=a的H2SO4溶液VaL与pH=b的NaOH溶液VbL混合,若所得混合液为中性,且a+b=12,则Va :Vb= 。
(6)在25℃下,将a mol?L-1的氨水与0.01 mol?L-1的盐酸等体积混合,反应平衡时溶液中c(NH4+)=c(Cl-)。则溶液显_____________性(填“酸”“碱”或“中”);用含a的代数式表示NH3?H2O的电离常数Kb=__________。
(14分)运用化学反应原理研究氮、氧等单质及其化合物的反应有重要意义。
(1)合成氨反应反应N2(g)+3H2(g)![]() 2NH3(g),若在恒温、恒压条件下向平衡体系中通入氩气,平衡 移动(填“向左”“向右”或“不”);,使用催化剂 反应的ΔH(填“增大”“减小”或“不改变”)。
2NH3(g),若在恒温、恒压条件下向平衡体系中通入氩气,平衡 移动(填“向左”“向右”或“不”);,使用催化剂 反应的ΔH(填“增大”“减小”或“不改变”)。
(2)O2 (g)= O+2(g)+e- ![]() H1= 1175.7 kJ?mol-1
H1= 1175.7 kJ?mol-1
PtF6(g)+ e-1 ![]() PtF6-(g)
PtF6-(g) ![]() H2= - 771.1 kJ?mol-1
H2= - 771.1 kJ?mol-1
O2+PtF6-(s)=O2+(g)+PtF6- ![]() H3=482.2 kJ?mol-1
H3=482.2 kJ?mol-1
![]() 则反应O2(g)+ PtF6 (g) = O2+PtF6- (s)的
则反应O2(g)+ PtF6 (g) = O2+PtF6- (s)的![]() H=_____________ kJ?mol-1。
H=_____________ kJ?mol-1。
![]() (3)在25℃下,向浓度均为0.1 mol?L-1的MgCL2和CuCl2混合溶液中逐滴加入氨水,先生成__________沉淀(填化学式),生成该沉淀的离子方程式为____________。已知25℃时Ksp[Mg(OH)2]=1.8×10-11,KsP[Cu(OH)2]=2.2×10-20。
(3)在25℃下,向浓度均为0.1 mol?L-1的MgCL2和CuCl2混合溶液中逐滴加入氨水,先生成__________沉淀(填化学式),生成该沉淀的离子方程式为____________。已知25℃时Ksp[Mg(OH)2]=1.8×10-11,KsP[Cu(OH)2]=2.2×10-20。
![]() (4)在25℃下,将a mol?L-1的氨水与0.01 mol?L-1的盐酸等体积混合,反应平衡时溶液中c(NH4*)=c(Cl-),则溶液显_____________性(填“酸”“碱”或“中”);用含a的代数式表示NH3?H2O的电离常数Kb=__________。
(4)在25℃下,将a mol?L-1的氨水与0.01 mol?L-1的盐酸等体积混合,反应平衡时溶液中c(NH4*)=c(Cl-),则溶液显_____________性(填“酸”“碱”或“中”);用含a的代数式表示NH3?H2O的电离常数Kb=__________。
运用化学反应原理研究氮、氧等单质及其化合物的反应有重要意义。
![]() (1)合成氨反应反应N2(g)+3H2(g)
(1)合成氨反应反应N2(g)+3H2(g)![]() 2NH3(g),若在恒温、恒压条件下向平衡体系中通入氩气,平衡 移动(填“向左”“向右”或“不”);,使用催化剂 反应的ΔH(填“增大”“减小”或“不改变”)。
2NH3(g),若在恒温、恒压条件下向平衡体系中通入氩气,平衡 移动(填“向左”“向右”或“不”);,使用催化剂 反应的ΔH(填“增大”“减小”或“不改变”)。
![]() (2)O2 (g)= O+2(g)+e-
(2)O2 (g)= O+2(g)+e- ![]() H1= 1175.7 kJ?mol-1
H1= 1175.7 kJ?mol-1
![]() PtF6(g)+ e-1
PtF6(g)+ e-1 ![]() PtF6-(g)
PtF6-(g) ![]() H2= - 771.1 kJ?mol-1
H2= - 771.1 kJ?mol-1
![]() O2+PtF6-(s)=O2+(g)+PtF6-
O2+PtF6-(s)=O2+(g)+PtF6- ![]() H3=482.2 kJ?mol-1
H3=482.2 kJ?mol-1
![]() 则反应O2(g)+ PtF6 (g) = O2+PtF6- (s)的
则反应O2(g)+ PtF6 (g) = O2+PtF6- (s)的![]() H=_____________ kJ?mol-1。
H=_____________ kJ?mol-1。
![]() (3)在25℃下,向浓度均为0.1 mol?L-1的MgCL2和CuCl2混合溶液中逐滴加入氨水,先生成__________沉淀(填化学式),生成该沉淀的离子方程式为____________。已知25℃时Ksp[Mg(OH)2]=1.8×10-11,KsP[Cu(OH)2]=2.2×10-20。
(3)在25℃下,向浓度均为0.1 mol?L-1的MgCL2和CuCl2混合溶液中逐滴加入氨水,先生成__________沉淀(填化学式),生成该沉淀的离子方程式为____________。已知25℃时Ksp[Mg(OH)2]=1.8×10-11,KsP[Cu(OH)2]=2.2×10-20。
![]() (4)在25℃下,将a mol?L-1的氨水与0.01 mol?L-1的盐酸等体积混合,反应平衡时溶液中c(NH4*)=c(Cl-),则溶液显_____________性(填“酸”“碱”或“中”);用含a的代数式表示NH3?H2O的电离常数Kb=__________。
(4)在25℃下,将a mol?L-1的氨水与0.01 mol?L-1的盐酸等体积混合,反应平衡时溶液中c(NH4*)=c(Cl-),则溶液显_____________性(填“酸”“碱”或“中”);用含a的代数式表示NH3?H2O的电离常数Kb=__________。
 2NH3(g),若在恒温、恒压条件下向平衡体系中通入氩气,则平衡 移动(填“向左”“向右”或“不”);使用催化剂,上述反应的△H________(填“增大” “减小” 或“不改变”)。
2NH3(g),若在恒温、恒压条件下向平衡体系中通入氩气,则平衡 移动(填“向左”“向右”或“不”);使用催化剂,上述反应的△H________(填“增大” “减小” 或“不改变”)。 式),生成该沉淀的离子方程式为____________。已知25℃时Ksp[Mg(OH)2]=1.8×10-11,Ksp[Cu(OH)2]=2.2×10-20。
式),生成该沉淀的离子方程式为____________。已知25℃时Ksp[Mg(OH)2]=1.8×10-11,Ksp[Cu(OH)2]=2.2×10-20。 中性,则Va︰Vb= 。
中性,则Va︰Vb= 。

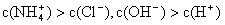

 NH3·H2O + H+,则该反应常温下的平衡常数K= (已知:常温下,NH3·H2O的电离平衡常数Kb=1.7×10—5 mol·L—1)
NH3·H2O + H+,则该反应常温下的平衡常数K= (已知:常温下,NH3·H2O的电离平衡常数Kb=1.7×10—5 mol·L—1)(生物部分)
1-5 DDBCC
30.(20分,每空2分)
(1)①45 ②B ③26 87
(2)①有囊膜和刺突 糖蛋白
②(正)反馈
③以病毒核酸为模板,利用宿主细胞内原料合成的抗原分子
④溶酶体酶 通透性.渗透压
31. (22分)
(1)光照强度(2分)
CO2(或NaHCO3溶液)、温度、PH值、黑藻(2分,要求至少答出两项)
(2)读量筒中收集到的水的体积(2分)
(3)(3分,坐标轴标识2分、绘图2分)

(4)黑藻自身的呼吸作用会消耗氧气(4分)
(5)在20―200W范围内随着光照强度的不断升高,光合作用产生的氧气量也在升高,但光照强度达500W时氧气量反而降低,说明适度提高光照强度可以提高光合作用的强度。(4分,分析2分,结论2分)
(6)在100-500W范围内设置多组梯度进行实验。(4分,范围及梯度各2分)
荆州中学高三上学期期末理综卷
参考答案
(化学部分)
6-13CDCBD BDD
26.(14分)⑴A. NaHSO4 B. MgSO
⑵2H++SO42-+Ba2++2OH-====BaSO4↓+2H2O
⑶NH4NO3(s)====2H2O(g)+N2(g)+1/202(g);ΔN=-119.2kJ/mol
 27.(16分)⑴VIA ⑵S
27.(16分)⑴VIA ⑵S
⑶
⑷< NH4++H2O NH3?H2O+H+
NH3?H2O+H+
⑸金属质量 N元素或原子,电子得失(或化合价升降),金属与硝酸的反应
28.(15分)⑴Mg(2分) 直线形(2分)
⑵催化剂,加热(2分)
⑶将D溶液在HCl气流中蒸干(3分)
⑷2NH42+2e-===2NH3↑+H2↑(3分)
⑸2Mg+CO2 2MgO+C(3分)
2MgO+C(3分)
荆州中学高三上学期期末理综卷
参考答案
(物理部分)
14 A 15 C 16 AC 17. B 18.D 19 BD 20 C 21 D
22 Ⅰ、电流表外接,滑动变阻器限流、分压都可 Ⅱ、 229Ω(220~237Ω均算正确)
Ⅲ 、 0.800cm 0.194cm Ⅳ、 8.46×10-2Ωm (8.16×10-2 ~ 8.76×10-2Ωm均可)
23.由牛顿第二定律有 a =  m/s2 向左 , 球从10m/s 减速到0
m/s2 向左 , 球从10m/s 减速到0
运动S1 =  需的时间
t1 =
需的时间
t1 =  s
s
在F作用的最后 1 s,因 F > Fu ,球向左加速 a2 =  m/s2 向左
m/s2 向左
在这1s 内,球的位移 S =  = 0.5m 达到
v3 = a2t = 1 m/s 向左
= 0.5m 达到
v3 = a2t = 1 m/s 向左
撤去力 F 后球减速到停止 a3 =  m/s2
m/s2
得球又向左运动S =  m 故总位移为
S = S1?S2?S3 = 9.25 m
m 故总位移为
S = S1?S2?S3 = 9.25 m
24 铜块压缩弹簧到最短的过程中,系统动量守恒、mv0 = ( m +M )v
能量守恒
 Wf =
Wf =  + Epm
+ Epm
铜块回到右端过程中系统有满足动量守恒( m +M )v = (m + M )v/
能量守恒  + Epm - Wf =
+ Epm - Wf = 
得 Wf = Epm
故 EPm= 
25 设圆半径为R ,粒子电量为q 质量为 m
粒子匀速穿过场区时 qE = q v0B
2 R = v0 T0
撤去磁场,粒子在电场中做类平抛运动
由几何关系得 x = 3 R/2 = v0t1
故 t1/T0 = 3 /4
撤去电场后粒子在磁场中做匀速圆周运动,设半径为 r,周期为 T
由qv0B = mv02/r 得
r = mv0 /qB T = 2πm/qB
由几何关系有 r =
 tan
tan =
= 
所以 t2 = 
故 
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com