
题目列表(包括答案和解析)

| ||
| ||
| ||
| ||
(15分)下图中所有物质均为中学化学常见物质,F、H是气体单质,Z是金属单质,Y中阳离子与阴离子个数比为2 :1,化合物X、Y、A、D、E、G的焰色反应均为黄色,I是白色胶状沉淀。
请回答下列问题:
(1)Y的电子式 。关于Y的说法正确的是 。
A.Y是酸性氧化物 B. Y是过氧化物 C. Y是碱性氧化物 D. Y可以作漂白剂
(2)J溶液中离子浓度由大到小的顺序为_____________________________________________。
(3)写出G与盐酸反应生成I的离子方程式 。
(4)写出B与Y反应的化学方程式 。
(5)将一定量的黄绿色气体W2通入到E的溶液中,两者恰好完全反应(已知反应过程放热),生成物中有三种含W元素的离子,其中两种离子的物质的量(n)与反应时间(t)的变化如图所示。该反应中转移电子的物质的量是 mol,该反应总反应的化学方程式为
。
(15分)下图中所有物质均为中学化学常见物质,F、H是气体单质,Z是金属单质,Y中阳离子与阴离子个数比为2 :1,化合物X、Y、A、D、E、G的焰色反应均为黄色,I是白色胶状沉淀。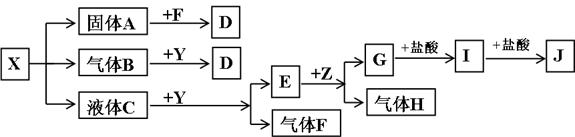
请回答下列问题:
(1)Y的电子式 。关于Y的说法正确的是 。
A.Y是酸性氧化物 B. Y是过氧化物 C. Y是碱性氧化物 D. Y可以作漂白剂
(2)J溶液中离子浓度由大到小的顺序为_____________________________________________。
(3)写出G与盐酸反应生成I的离子方程式 。
(4)写出B与Y反应的化学方程式 。
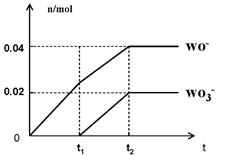
(5)将一定量的黄绿色气体W2通入到E的溶液中,两者恰好完全反应(已知反应过程放热),生成物中有三种含W元素的离子,其中两种离子的物质的量(n)与反应时间(t)的变化如图所示。该反应中转移电子的物质的量是 mol,该反应总反应的化学方程式为
。
(15分)下图中所有物质均为中学化学常见物质,F、H是气体单质,Z是金属单质,Y中阳离子与阴离子个数比为2 :1,化合物X、Y、A、D、E、G的焰色反应均为黄色,I是白色胶状沉淀。
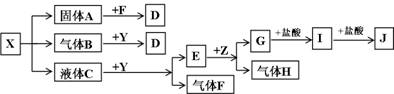
请回答下列问题:
(1)Y的电子式 。关于Y的说法正确的是
A.Y是酸性氧化物 B.Y是过氧化物
C.Y是碱性氧化物 D.Y可以作漂白剂
(2)J溶液中离子浓度由大到小的顺序为__________________________________
(3)写出G与盐酸反应生成I的离子方程式
(4)写出B与Y反应的化学方程式
(5)将一定量的黄绿色气体W2通入到E的溶液中,两者恰好完全反应(已知反应过程放热),生成物中有三种含W元素的离子,其中两种离子的物质的量(n)与反应时间(t)的变化如图所示。
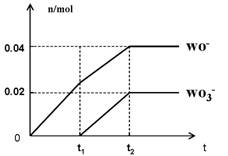
该反应中转移电子的物质的量是 mol,该反应总反应的化学方程式为 。
一、选择题:
1.B 2.A 3.C 4.B 5.D 6.B 7.B 8.C 9.A 10.B 11.A 12.C
二、选择题:
13.B  14.BC 15.B 16.C.17.AD 18.BC 19.AB 20.C
14.BC 15.B 16.C.17.AD 18.BC 19.AB 20.C
三、
21.B C D E
22.⑴K2CO3 、AlCl3、BaCl2;
⑵产生白色沉淀,后沉淀逐渐溶解;
⑶①中;②Ba2++OH-+H++SO2- 4=BaSO4↓+H2O;③13
四、
23.本题答案有开放性,合理即可给分。
⑴①C(或Fe) ②
⑶①CaC2+2H2O=Ca(OH)2+C2H2↑ ;②麦芽糖;
⑷①Na2CO3+CO2+H2O=2NaHCO3 ;②红褐色固体。
24.
编号
1
2
3
4
5
X的化学式
Na
Na2O
Na2O2
NaOH
NaH
加入X的质量(g)
4.6
6.2
7.8
8.0
4.8
五、
25.(1)醛基;略(为羧基的结构式);
(2)氧化反应;酯化反应;

 (3)
(4)
(3)
(4)

六、
26.

(0, 0.7) (0.1, 0.4) (0.2, 0.3) (0.3, 0.4) (0.4, 0.7) (0.5, 0.7)
(每1折点1分,离子方程式每个1分)
 w.w.w.k.s.5.u.c.o.m
w.w.w.k.s.5.u.c.o.m
www.ks5u.com
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com