
题目列表(包括答案和解析)
某同学用下列装置制备并检验Cl2的性质。


(1)I图圆底烧瓶中反应的化学方程式是 。
(2)II图中褪色的是 (填a或b),烧杯中反应的离子方程式是
。
(3)①将Cu丝换成Fe丝,做III实验,结果也能点燃,你认为Fe丝也可点燃的理由是 。
a.Fe与Cu都是金属元素 b.Fe的熔点比Cu高
c.Fe的密度比Cu小 d.Fe的金属性比Cu强
②通常由燃烧产物(FeCl3)配制其溶液的方法是
。
(4)将IV装置放置在光亮的地方(日光没有直接照射),一会儿后,观察到量筒壁上有油状液滴生成,量筒内液面上降。油状液滴的成分可能是(写分子式) ,
量筒内液面上升的原因是 。
(5)将硫酸溶液滴入II图烧杯中,至溶液显酸性,结果也有Cl2生成,该反应的离子方程式是 。
某同学设计了如下图所示装置(部分夹持装置已略去)进行实验研究。

请回答:
(1)用上述装置探究影响化学反应速率的因素。
①圆底烧瓶中发生反应的离子方程式是 。
②用上述装置进行实验,以生成9.0 mL气体为计时终点,结果为 。
。
|
序号 |
V(H2SO4)/mL |
C(H2SO4)/mol·L-1 |
t/s |
|
I |
40 |
1 |
t1 |
|
II |
40 |
4 |
t2 |
比较实验I和Ⅱ可以得出的实验结论是 。
实验过程中,对量气管的操作是 。
③若将锌片换成含杂质的粗锌片,且控制其他条件使其与上述实验完全一致,所测得的反应速率均大于上述实验对应的数据。粗锌片中所含杂质可能是(填序号) 。
A.石墨 b.银 c.铜d.沙粒(二氧化硅)
(2)用上述装置验证生铁在潮湿空气中会发生吸氧腐蚀。
①圆底烧瓶中的试剂可选用(填序号) 。
a.NaOH溶液 b.C2H5OH c.NaCl溶液 d.稀硫酸
②能证明生铁在潮湿空气中会发生吸氧腐蚀的现象是 。
某同学设计了如下图所示装置(部分夹持装置已略去)进行实验研究。
请回答:
(1)用上述装置探究影响化学反应速率的因素。
①圆底烧瓶中发生反应的离子方程式是 。
②用上述装置进行实验,以生成9.0 mL气体为计时终点,结果为![]() 。
。
| 序号 | V(H2SO4)/mL | C(H2SO4)/mol·L-1 | t/s |
| I | 40 | 1 | t1 |
| II | 40 | 4 | t2 |
比较实验I和Ⅱ可以得出的实验结论是 。
实验过程中,对量气管的操作是 。
③若将锌片换成含杂质的粗锌片,且控制其他条件使其与上述实验完全一致,所测得的反应速率均大于上述实验对应的数据。粗锌片中所含杂质可能是(填序号) 。
A.石墨 b.银 c.铜d.沙粒(二氧化硅)
(2)用上述装置验证生铁在潮湿空气中会发生吸氧腐蚀。
①圆底烧瓶中的试剂可选用(填序号) 。
a.NaOH溶液 b.C2H5OH c.NaCl溶液 d.稀硫酸
②能证明生铁在潮湿空气中会发生吸氧腐蚀的现象是 。
(15分)二氧化硫是重要的工业原料,探究其制备方法和性质具有非常重要的意义。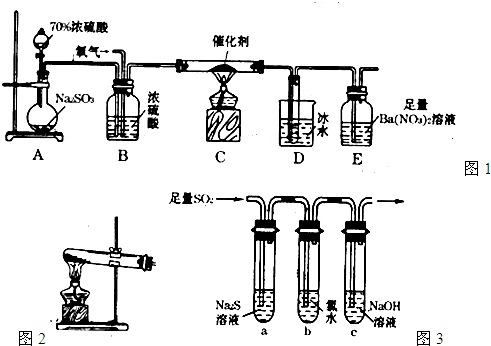
(1)实验室用图1装置测定SO2催化氧化为SO3的转化率。(已知SO3熔点为16.8℃,假设气体进入装置时分别被完全吸收,且忽略空气中CO2的影响。)
①简述使用分液漏斗向圆底烧瓶中滴加浓硫酸的操作: 。
②实验过程中,需要通入氧气。试写出一个用如图2所示装置制取氧气的化学方程式: 。
③当停止通入SO2熄灭酒精灯后,需要继续通一段时间的氧气,其目的是: 。
④实验结束后,若装置D增加的质量为mg,装置E中产生白色沉淀的质量为ng,则此
条件下二氧化硫的转化率是 (用含字母的代数式表示,不用化简)。
(2)某学习小组设计用如图3装置验证二氧化硫的化学性质。
①能说明二氧化硫具有氧化性的实验现象为: 。
②为验证二氧化硫的还原性,充分反应后,取试管b中的溶液分三份,分别进行如下实验。
方案I:向第一份溶液中加入AgNO3溶液,有白色沉
淀生成。
方案II:向第二份溶液中加入品红溶液,红色褪去。
方案III:向第三份溶液中加入BaC12溶液,产生白色沉淀
上述方案中合理的是 (填“I”、“II”、或“III”);
试管b发生反应的离子方程式: 。
③当通入二氧化硫至试管c中溶液显中性时,该溶液中
c(Na+)= (用含硫微粒浓度的代数式表示)。

一、(每小题2分,共40分)
1―5 ADDBB 6―10 DCBDB 11―15 DBDDC 16―20 AACDB
二、
21.(1)CO2-3+H+=HCO-3 (2分)
(2)HCO-3+H+ =H2O+CO2↑ (2分)
|