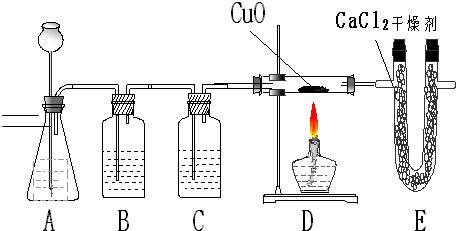
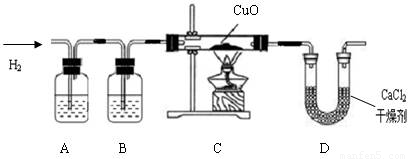
利用纯净、干燥的氢气还原灼热的氧化铜来测定水的组成.实验装置由A、B、C、D组成(氢气发生装置省略未画出).回答下列问题:

(1如果某学生用锌和较浓的盐酸制取氢气,他用装置A、B是为了得到纯净、干燥的氢气,在装置A中通常放______溶液,其作用是______;在装置B中通常放______溶液,其作用是______.
(2)若实验前后,称量结果如下,装氧化铜的玻璃管的质量减少6、4克,装氯化钙的U型管的质量增加了7、2克.根据上述实验数据,写出水中氢、氧两种元素质量比的原始计算式______.
(3)在装置D中,将CaCl
2改换为______,才能检验出氢气还原氧化铜有水生成.