
题目列表(包括答案和解析)
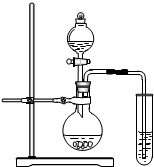
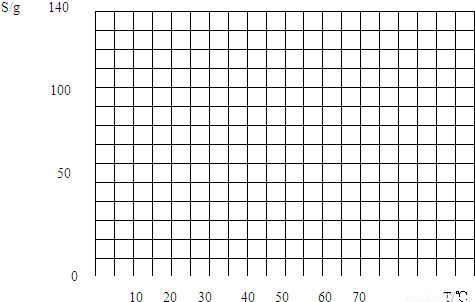
 某中学的初三学生计划在实验室中通过测定硝酸钾在不同温度下的溶解度以绘制出硝酸钾的溶解度曲线.具体实验方案:
某中学的初三学生计划在实验室中通过测定硝酸钾在不同温度下的溶解度以绘制出硝酸钾的溶解度曲线.具体实验方案:| 实验组号 | KNO3/g | H2O/g | 刚好出现晶体时的温度/℃ | 平均温度/℃ | 溶解度/g | ||
| 一 | 4 | 3 | 66.5 | 67.0 | 69 | 67.5 | 133.3 |
| 二 | 4 | 5 | 45.8 | 45.2 | 45.5 | 45.5 | |
| 三 | 4 | 7 | 32.5 | 33.0 | 33.0 | ||
| 四 | 4 | 9 | 27.8 | 27.3 | 27.0 | 27.4 | 44.4 |
| 五 | 4 | 10 | 25.8 | 30.1 | 26.1 | 40.0 | |

| 温度/℃ | 10 | 20 | 30 | 40 | 50 | 60 | 70 |
| KNO3/g | 20.9 | 31.6 | 45.8 | 63.9 | 85.5 | 110 | 138 |
| 温度/℃ | 10 | 20 | 30 | 40 | 50 | 60 | 70 |
| NaCl/g | 35.8 | 36.0 | 36.3 | 36.6 | 37.0 | 37.3 | 37.8 |
某研究性小组的学生在《化学手册》中查得在101kPa下,在不同温度时,CO2在水中的溶解度(单位为:mL/L)如下表所示:
|
 下列是初三某合作学习小组实验室制取二氧化碳气体
下列是初三某合作学习小组实验室制取二氧化碳气体| 比较项目 | 排水法 | 向上排空气法 |
| 收集方法可行性分析 | CO2气体生成和从水面逸出的速率远大于其溶解和与水反应的速率 | CO2密度比空气大, 不与空气发生反应 不与空气发生反应 . |
| 收集过程分析 | 集满现象: 集气瓶口有气泡冒出 集气瓶口有气泡冒出 . |
“验满”分析:因气体无色,故集满与否较难确定.即便用燃着木条移近容器口火焰熄灭,也难以证明空气完全排尽. |
| 向收集到的CO2集气瓶内倒入等体积适量澄清石灰水,并振荡 | 先浑浊后变澄清所需时间较短. | 先浑浊后变澄清所需时间较长. |
| 由上述实验可得结论 | ① 二氧化碳可用排水法或向上排空气法收集; 二氧化碳可用排水法或向上排空气法收集; ;②用排水法收集到的二氧化碳比较纯净 用排水法收集到的二氧化碳比较纯净 . | |
| 试管编号 | 1 | 2 | 3 | 4 | 5 |
| 硫酸浓度(%) | 15 | 20 | 25 | 30 | 35 |
| 气体体积(mL) | 35 | 47 | 55 | 51 | 42 |
| 试管编号 | A | B | C | D | E |
| 温度(℃) | 40 | 50 | 60 | 70 | 80 |
| 现象和 比较 |
有少量气泡 | 气泡比A号试管多 | 气泡明显比B号试管多 | 大量气泡产生,与常温用盐酸反应相似 | 反应激烈,迅速产生大量气体 |
 下列是初三某合作学习小组实验室制取二氧化碳气体的研究过程,请你参与其中.
下列是初三某合作学习小组实验室制取二氧化碳气体的研究过程,请你参与其中.| 比较项目 | 排水法 | 向上排空气法 |
| 收集方法可行性分析 | CO2气体生成和从水面逸出的速率远大于其溶解和与水反应的速率 | CO2密度比空气大,且 不与空气反应 不与空气反应 . |
| 收集过程分析 | 集满现象: 集气瓶口有气泡冒出 集气瓶口有气泡冒出 . |
“验满”分析:因气体无色,故集满与否较难确定.即便用燃着木条移近容器口火焰熄灭,也难以证明空气完全排尽. |
| 向收集到的CO2集气瓶内倒入等体积适量澄清石灰水,并振荡 | 先浑浊后变澄清所需时间较短. | 先浑浊后变澄清所需时间较长. |
| 由上述实验可得结论 | ① 二氧化碳可用排水法或向上排空气法收集 二氧化碳可用排水法或向上排空气法收集 ;②用排水法收集到的二氧化碳比较纯净 用排水法收集到的二氧化碳比较纯净 . | |
| 试管编号 | 1 | 2 | 3 | 4 | 5 |
| 硫酸浓度(%) | 15 | 20 | 25 | 30 | 35 |
| 气体体积(mL) | 35 | 47 | 55 | 51 | 42 |
| 试管编号 | A | B | C | D | E |
| 温度(℃) | 40 | 50 | 60 | 70 | 80 |
| 现象和 比较 |
有少量气泡 | 气泡比A号试管多 | 气泡明显比B号试管多 | 大量气泡产生,与常温用盐酸反应相似 | 反应激烈,迅速产生大量气体 |
| 实验组号 | KNO3/g | H2O/g | 刚好出现晶体时的温度/℃ | 平均温度/℃ | 溶解度/g | ||
| 一 | 4 | 3 | 66.5 | 67.0 | 69 | 67.5 | 133.3 |
| 二 | 4 | 5 | 45.8 | 45.2 | 45.5 | 45.5 | |
| 三 | 4 | 7 | 32.5 | 33.0 | 33.0 | ||
| 四 | 4 | 9 | 27.8 | 27.3 | 27.0 | 27.4 | 44.4 |
| 五 | 4 | 10 | 25.8 | 30.1 | 26.1 | 40.0 | |
| 温度/℃ | 10 | 20 | 30 | 40 | 50 | 60 | 70 |
| KNO3/g | 20.9 | 31.6 | 45.8 | 63.9 | 85.5 | 110 | 138 |
| 温度/℃ | 10 | 20 | 30 | 40 | 50 | 60 | 70 |
| NaCl/g | 35.8 | 36.0 | 36.3 | 36.6 | 37.0 | 37.3 | 37.8 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com