
题目列表(包括答案和解析)
为了检验某石材是否含有碳酸盐,进行如下实验(装置如下图所示):先在锥形瓶中加入石材样品碎块,再加入一定量的稀盐酸,观察现象,得出结论。试回答以下问题:
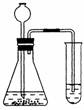
⑴为达到实验目的,右边试管中应加入 。
⑵如果观察到锥形瓶中有 ,试管中有 的现象现时,
证明该石材中含有碳酸盐。
⑶请写出右边试管中反应的化学方程式 。
⑷如何检验左边气体发生装置的气密性?请写出两种方法。
方法一 。
方法二 。
⑸若该碳酸盐是碳酸钙,取12.5g该石材样品充分灼烧,冷却后称得残留固体为8.1g。试通过计算确定该石材样品中碳酸盐的质量分数。(假设该石材样品中其它成分加热不分解。
小明将家中清洗伤口用的消毒液——“双氧水”拿到学校的实验室,在老师的指导下和同学们一起做了如下实验。
【第一组实验】检验该双氧水是否失效。
⑴ 实验过程
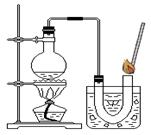
①在试管中加入5 mL 的“双氧水”,把带火星的木条伸入试管中,发现木条未复燃;
②用酒精灯给上述试管加热,液体中有气泡产生,把带火星的木条伸入试管中,发现木条仍未复燃;
③如右图装置进行操作,带火星的木条复燃,水槽中冰水所起的作用是 。
⑵ 实验结论: 。
【第二组实验】探究:氧化铜(CuO)能否催化“双氧水”分解
[猜想] Ⅰ. CuO不是催化剂、也不参与反应,反应前后质量和化学性质不变;
Ⅱ. CuO参与反应产生O2,反应前后质量和化学性质发生了改变;
Ⅲ. CuO是反应的催化剂,反应前后 。
[实验]用天平称量0.2gCuO,取5mL的过氧化氢溶液于试管中,进行如下实验: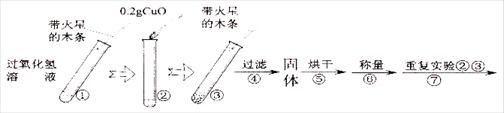
⑶ 完成下表:
| 步骤③现象 | 步骤⑥结果 | 步骤⑦现象 | 结论 |
| 溶液中 , 带火星的木条复燃。 | | 溶液中有气泡放出, 。 | 猜想Ⅰ、Ⅱ不成立,猜想Ⅲ成立。 |

小明将家中清洗伤口用的消毒液——“双氧水”拿到学校的实验室,在老师的指导下和同学们一起做了如下实验。
【第一组实验】检验该双氧水是否失效。
⑴ 实验过程
①在试管中加入5 mL 的“双氧水”,把带火星的木条伸入试管中,发现木条未复燃;
②用酒精灯给上述试管加热,液体中有气泡产生,把带火星的木条伸入试管中,发现木条仍未复燃;
③如右图装置进行操作,带火星的木条复燃,水槽中冰水所起的作用是 。
⑵ 实验结论: 。
【第二组实验】探究:氧化铜(CuO)能否催化“双氧水”分解
[猜想] Ⅰ. CuO不是催化剂、也不参与反应,反应前后质量和化学性质不变;
Ⅱ. CuO参与反应产生O2,反应前后质量和化学性质发生了改变;
Ⅲ. CuO是反应的催化剂,反应前后 。
[实验]用天平称量0.2gCuO,取5mL的过氧化氢溶液于试管中,进行如下实验:
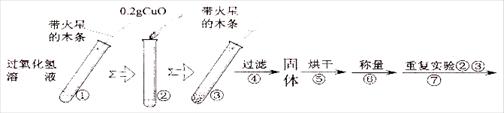
⑶ 完成下表:
|
步骤③现象 |
步骤⑥结果 |
步骤⑦现象 |
结论 |
|
溶液中 , 带火星的木条复燃。 |
|
溶液中有气泡放出, 。 |
猜想Ⅰ、Ⅱ不成立,猜想Ⅲ成立。 |
⑷ 步骤③结束后,用手接触试管底部,感觉烫手。说明“双氧水”分解的化学反应 (选填“放热”或“吸热”)。
⑸ 步骤④需用到的实验仪器有:铁架台(带铁圈)、漏斗(带滤纸)、烧杯、 。
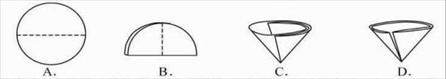
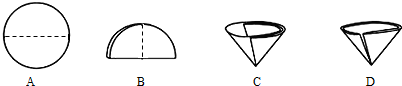
⑹ 操作④中需要将圆形滤纸折叠处理,下列图示中不该出现的情形是 _(填序号).
⑺ 步骤⑦的目的
⑻ 过氧化氢能被CuO催化分解放出O2的反应表达式为 。
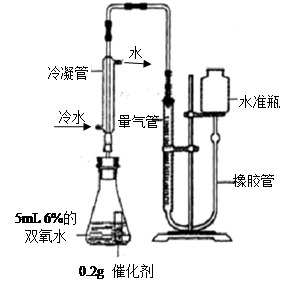
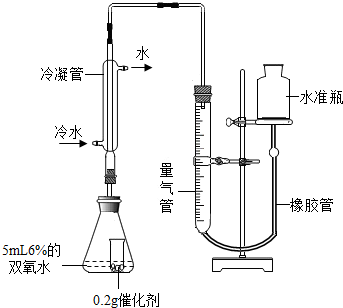
【第三组实验】探究:不同种类催化剂能否改变“双氧水”分解出氧气的量
[实验]分别选用二氧化锰与氧化铜,采用下图试剂与装置实验,测量所得氧气的体积
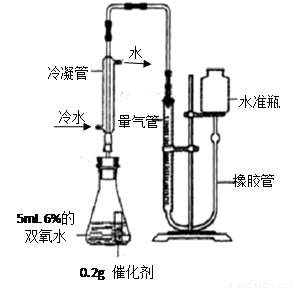
⑼ 检查该装置气密性的方法是连接好装置,从水准瓶注水,量气管中液面与右边液面形成高度差,做好标记,一段时间后,两边高度差 (填“变大”、“变小”或“不变”),说明气密性良好。
⑽ 使用冷水冷凝的目的是 _。反应前应将液面调节到量气管的“0”刻度,并使两边液面相平,反应后读数前,还需要进行的操作是 。
⑾ 两次实验表明,使用不同催化剂在常温下测得量气管读数均为112.0mL(O2的密度为1.43 g/L),则实验中选用的量气管规格合适的是 (填字母序号)。
A. 100 mL B.200 mL C. 500 mL
⑿ [实验结论]:不同种类的催化剂 改变双氧水分解出氧气的量。
【拓展研究】查阅资料得知实验所取5mL 6%双氧水中含过氧化氢(H2O2)0.34 g。请计算说明过氧化氢中的氧元素是否全部转化为氧气。(请写出计算过程,4分)


| 步骤③现象 | 步骤⑥结果 | 步骤⑦现象 | 结论 |
| 溶液中 , 带火星的木条复燃。 | | 溶液中有气泡放出, 。 | 猜想Ⅰ、Ⅱ不成立,猜想Ⅲ成立。 |


 小明将家中清洗伤口用的消毒液--“双氧水”拿到学校的实验室,在老师的指导下和同学们一起做了如下实验.
小明将家中清洗伤口用的消毒液--“双氧水”拿到学校的实验室,在老师的指导下和同学们一起做了如下实验.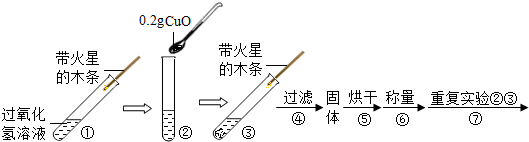
| 步骤③现象 | 步骤⑥结果 | 步骤⑦现象 | 结论 |
| 溶液中 有气泡冒出 有气泡冒出 ,带火星的木条复燃. |
仍为0.2g (或氧化铜质量不变) 仍为0.2g (或氧化铜质量不变) |
溶液中有气泡放出, 使带火星的木条复燃 使带火星的木条复燃 . |
猜想Ⅰ、Ⅱ不成立,猜想Ⅲ成立. |
| CuO |
| CuO |
 (9)检查该装置气密性的方法是连接好装置,从水准瓶注水,量气管中液面与右边液面形成高度差,做好标记,一段时间后,两边高度差
(9)检查该装置气密性的方法是连接好装置,从水准瓶注水,量气管中液面与右边液面形成高度差,做好标记,一段时间后,两边高度差湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com