
题目列表(包括答案和解析)
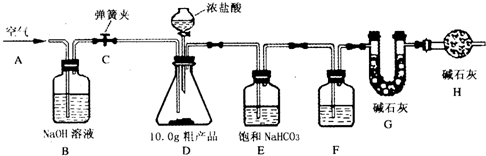
某化学兴趣小组的同学在学习了纯碱(Na2CO3)的性质以后,联想到家庭中蒸制馒头
时常用的物质小苏打(NaHCO3),于是采用市售小苏打样品进行了如下的实验探究。
实验一: 探究碳酸氢钠的化学性质
(1)取样品溶于适量的水中,测得溶液的pH大于7。
(2)向小苏打固体中滴加盐酸,有大量气泡产生,该气体经检验是二氧化碳。
该反应的化学方程式为 。
(3)取小苏打的溶液加入澄清石灰水,生成了白色沉淀。
(4)同学们通过查阅资料,在老师的指导下采用了右图装置
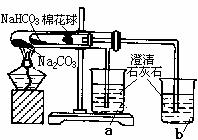
对小苏打和纯碱做了对比实验。实验中小试管内沾有无水硫酸铜粉末的棉花球变成蓝色,a烧杯中石灰水无明显现象,
b烧杯中石灰水出现白色浑浊。
①在实验结束时,操作上要特别注意的问题是:
;
②由实验现象可以得出的结论是 。
(5)请你根据以上实验,归纳出小苏打的化学性质(至少三点):
。
实验二: 测定小苏打样品中NaHCO3的质量分数
市售的小苏打样品NaHCO3的质量分数的标注为95%,该兴趣小组对此产生了疑问,于是又进行了下面的实验。(假设小苏打样品中的杂质可溶解于水,对实验测定无影响)
方案1:取10 g固体样品加水完全溶解后,加入足量澄清石灰水,反应方程式如下:
Ca(OH)2 + NaHCO3= CaCO3↓+ NaOH + H2O ,过滤得到沉淀CaCO3, 干燥后称量质量为10 g。经计算得到NaHCO3质量为8.4g。
结论:小苏打样品中NaHCO3的质量分数仅为84 %,低于标注。
利用本题中给出的信息,请你设计出新的测定方案,简述实验方法和结论。
 27、某化学兴趣小组的同学在学习了纯碱(Na2CO3)的性质后,联想到家中蒸制馒头时常用的物质小苏打(NaHCO3),于是采用市售的小苏打样品进行了如下实验探究.
27、某化学兴趣小组的同学在学习了纯碱(Na2CO3)的性质后,联想到家中蒸制馒头时常用的物质小苏打(NaHCO3),于是采用市售的小苏打样品进行了如下实验探究.某化学兴趣小组的同学在学习了纯碱(Na2CO3)的性质以后,联想到家庭中蒸制馒头
时常用的物质小苏打(NaHCO3),于是采用市售小苏打样品进行了如下的实验探究。
实验一: 探究碳酸氢钠的化学性质
(1)取样品溶于适量的水中,测得溶液的pH大于7。
(2)向小苏打固体中滴加盐酸,有大量气泡产生,该气体经检验是二氧化碳。
该反应的化学方程式为 。

(3)取小苏打的溶液加入澄清石灰水,生成了白色沉淀。
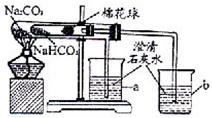
(4)同学们通过查阅资料,在老师的指导下采用了右图装置
对小苏打和纯碱做了对比实验。实验中小试管内沾有无水硫酸铜粉末的棉花球变成蓝色,a烧杯中石灰水无明显现象,
b
烧杯中石灰水出现白色浑浊。①在实验结束时,操作上要特别注意的问题是:
;
②由实验现象可以得出的结论是 。
(5)请你根据以上实验,归纳出小苏打的化学性质(至少三点):
。
实验二: 测定小苏打样品中NaHCO3的质量分数
市售的小苏打样品NaHCO3的质量分数的标注为95%,该兴趣小组对此产生了疑问,于是又进行了下面的实验。(假设小苏打样品中的杂质可溶解于水,对实验测定无影响)
方案1:取10 g固体样品加水完全溶解后,加入足量澄清石灰水,反应方程式如下:
Ca(OH)2 + NaHCO3= CaCO3
↓+ NaOH + H2O ,过滤得到沉淀CaCO3, 干燥后称量质量为10 g。经计算得到NaHCO3质量为8.4g。结论:小苏打样品中NaHCO3的质量分数仅为84 %,低于标注。
利用本题中给出的信息,请你设计出新的测定方案,简述实验方法和结论。
(6)方案2:
 某化学兴趣小组的同学在学习了纯碱(Na2CO3)的性质后,联想到家中蒸制馒头时常用的物质小苏打(NaHCO3),于是采用市售的小苏打样品进行了如下实验探究.
某化学兴趣小组的同学在学习了纯碱(Na2CO3)的性质后,联想到家中蒸制馒头时常用的物质小苏打(NaHCO3),于是采用市售的小苏打样品进行了如下实验探究.湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com