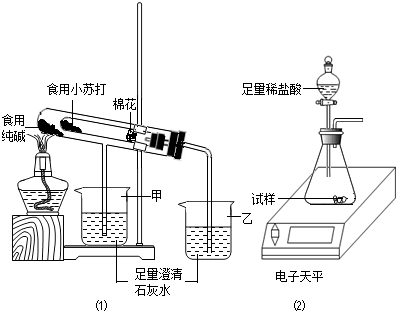
(2013?江阴市一模)某兴趣小组对食用纯碱和食用小苏打两种粉末进行以下探究.
(一)【定性探究】
[查阅资料]
| 名称 |
食用纯碱 |
食用小苏打 |
| 主要成分 |
Na2CO3 |
NaHCO3 |
| 酸碱性 |
水溶液显碱性 |
水溶液显碱性 |
| 热稳定性 |
受热不分解 |
270℃时完全分解为碳酸钠、二氧化碳、水 |
[实验探究]
(1)探究两者水溶液酸碱性的差异
小明分别向等浓度的两种溶液中滴入酚酞试液,发现两者都变
红
红
色,但食用纯碱溶液中颜色更深,由此推测可能
食用纯碱
食用纯碱
溶液碱性更强.小欢认为要比较两种溶液的碱性强弱,可直接用
pH试纸
pH试纸
进行测定.
(2)验证两种粉末的稳定性
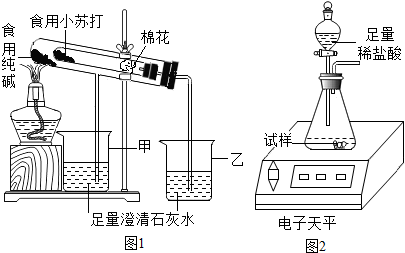
在老师的指导下,该小组按图1装置进行实验操作,观察到
乙
乙
(填“甲”或“乙”)烧杯中澄清石灰水变浑浊,试管中发生反应的化学方程式为
,装置中棉花的作用是
防止加热时小苏打(或NaHCO3)粉末进入导管
防止加热时小苏打(或NaHCO3)粉末进入导管
.
【拓展延伸】
(3)通过学习,我们知道小苏打(NaHCO
3)除用于食品工业外,在日常生活及实验室中还有很多应用,试举一例:
治疗胃酸过多
治疗胃酸过多
.
(二)【定量探究】
(4)取食用纯碱粉末试样,利用图2装置进行实验测定,数据记录如下:
| 称量项目 |
称量时间 |
质量/g |
| 试样 |
|
11.0 |
| 装置+稀盐酸 |
|
160.0 |
| 装置+稀盐酸+试样 |
反应开始后20s |
167.0 |
| 装置+稀盐酸+试样 |
反应开始后30s |
166.6 |
| 装置+稀盐酸+试样 |
反应开始后90s |
166.6 |
①反应生成CO
2的质量为
4.4
4.4
g.
②通过计算确定食用纯碱粉末中Na
2CO
3的质量分数为
96.4
96.4
%(结果保留一位小数)
③如果测得的结果比实际纯度高,可能的原因是
稀盐酸挥发出的HCl气体(或水蒸气)随CO2气体排出而导致所测纯度偏大
稀盐酸挥发出的HCl气体(或水蒸气)随CO2气体排出而导致所测纯度偏大
.(答一种即可)